Химиотерапия при раке простаты
Статистические сведения указывают на то, что рак предстательной железы является наиболее часто встречающимся среди мужчин. Причем уровень заболеваемости этой формой рака в каждой стране варьируется, лишь исходя из оснащенности медицинских учреждений. Слаборазвитые государства не имеют возможности диагностировать данную опухоль, но обнаруживают её в организме мужчины уже после смерти. Выходит так, что выраженной симптоматикой рак простаты при жизни больного себя не проявлял.
Известно, что эта форма онкологии является гормонозависимой. Развитие заболевания стимулируется мужскими половыми гормонами. Потому и первичный подход к лечению основывается на блокировке выработки гормонов или их деактивации (отключении выполняемых функций). Однако со временем поражение простаты становится слабочувствительным к принимаемым препаратам, что провоцирует необходимость поиска новых методов лечения. Одним из таких является химиотерапия.
Суть химиотерапии рака предстательной железы
Химиотерапевтические препараты блокируют процесс деления клеток злокачественного образования, замедляя или полностью останавливая рост опухоли. Ряд исследований указывает на то, что в сочетании с кастрационной терапией эти медикаменты повышают уровень выживаемости пациентов даже при метастазирующем раке простаты. Современная онкомедицина признаёт химиотерапию как основной метод при лечении гормонорезистентного поражения простаты и опухолей на 4-й стадии развития.
Цитотоксические средства назначаются только тем пациентам, которые способны переносить химиотерапию. Наряду с блокировкой злокачественных клеток, негативное воздействие оказывается на остальные системы и органы, в частности, на костный мозг и слизистую оболочку ЖКТ. Побочные эффекты неизбежны, но на поздней стадии развития рака простаты только химиотерапия может дать пациенту облегчение болевого синдрома и продлить срок жизни.
Показания и противопоказания к химиотерапии
Как уже было сказано, приоритетной стадией для начала приёма химиотерапевтических препаратов является четвертая, а также формы рака с проявлением метастазов в других частях организма. К химии, как к методу первой линии прибегают в следующих ситуациях:
- при больших размерах опухоли;
- при висцеральных метастазах и (или) наличии более четырёх очагов, проявившихся в костной ткани, в том числе, за пределами таза и поясничного отдела;
- при выраженном болевом синдроме.
В качестве метода второй линии химиотерапию назначают при кастрационно-резистентной форме опухоли. Однако, как уже было сказано, со временем развивается и гормональная устойчивость, а потому химиотерапевтические препараты выходят на первый план. Они же актуальны для первично гормонально нечувствительного рака предстательной железы и рецидивов опухоли, возникших после оперативного удаления.
На любой стадии заболевания есть строгие ограничения относительно потенциальных пациентов. Недопустимо проводить химиотерапию при наличии следующих проблем у больного:
- признаки печеночноклеточной недостаточности;
- нарушенная азотовыделительная функция почек;
- тромбоцитопения;
- нейтропения;
- кахексия;
- обострившаяся язвенная болезнь;
- активно протекающие инфекционные процессы;
- хронические патологии, сопутствующие опухоли;
- недавнее хирургическое вмешательство;
- повышенный уровень тестостерона (требуемое значение – менее 50 нг/мл);
- низкий уровень ПСА (до 2 нг/мл), не позволяющий оценить эффективность химиотерапии;
- отсутствие метастатических поражений.
Запомните! Для каждого клинического случая план лечения подбирается индивидуально. Только лечащий врач (зачастую в рамках консилиума) может сформировать курс приёма химиотерапевтических препаратов. Любые самоназначения могут не дать эффекта, либо, в худшем случае, нанести непоправимый вред здоровым органам пациента.
Подготовительный этап
После постановки диагноза «рак простаты» каждый пациент проходит спектр обследований, которые позволяют исключить вышеперечисленные противопоказания к проведению химиотерапии. Обязательно назначаются следующие проверочные процедуры:
- общеклинические анализы крови на уровень гемоглобина, количество лейкоцитов, нейтрофилов и тромбоцитов;
- биохимия крови с обязательной проверкой на креатинин, билирубин, печеночные трансамиазы;
- ФГДС для проверки слизистой оболочки ЖКТ и исключения язвенной болезни;
- ряд консультаций у профильных специалистов, способных выявить прочие патологические изменения организма.
Специалисты, курирующие химиотерапию в процессе лечения поражения предстательной железы, должны четко разъяснить цели и задачи назначаемых курсов исходя из стадии развития и распространённости опухоли. После согласования всех нюансов будет подписан соответствующий документ.
Если будут обнаружены противопоказания, то возможная отсрочка для проведения:
- переливания крови;
- устранения различных патологий и инфекционных процессов;
- дезинтоксикации;
- курса приёма гепатопротекторов, если наблюдается печеночная дисфункция.
Непосредственно перед введением химиотерапевтических средств санируется ротовая полость. Необходимо исключить такие источники инфекций как кариес и прочие поражения, приводящие к осложнениям из-за повышенной чувствительности, которая развивается в процессе лечения предстательной железы.
Побочные эффекты
Наряду с положительным эффектом, который оказывает химиотерапия при раке простаты, проявляются побочные из-за влияния на здоровые части организма. Их выраженность зависит от индивидуальных особенностей пациента. Большую часть из них можно скорректировать медикаментозно или иными сопроводительными процедурами.
В целом химиотерапия при раке, локализованном в пределах предстательной железы, может провоцировать:
- снижение уровня лейкоцитов и, как следствие, ухудшение иммунной защиты организма;
- ухудшение свёртываемости крови и предрасположенность к кровотечениям;
- анемию;
- тошноту и рвоту;
- стоматит и язвочки в ротовой полости;
- ухудшение аппетита, нарушение функций вкусовых рецепторов;
- выпадение волос;
- общую слабость и быструю утомляемость;
- диарею;
- задержку жидкости и отёчности;
- переферическую нейропатию.
Химиотерапевтические препараты, применяемые при раке предстательной железы, не обязательно проявляют свою активность полным набором побочных эффектов. Устранять те, которые проявились, можно при помощи:
- противорвотных средств;
- переливания крови (или выделенных субстанций с недостающими компонентами);
- препаратов для улучшения выработки клеток костным мозгом (при цитопении);
- полосканий для полости рта, в том числе с антисептическими веществами;
- строгой диеты и режима дня.
Также рекомендуется ограничить контакты с переносчиками инфекционных заболеваний, в частности, посещение учреждений с отрицательным микроклиматом для пациентов со злокачественным поражением предстательной железы. Если на определённой стадии лечения, проводимого при раке простаты, проявляются иные отрицательные эффекты, обуславливающие дискомфорт для пациента, необходимо говорить о них лечащему врачу.
Контроль эффективности химиотерапевтического лечения при раке простаты
Существуют регламентированные критерии оценки лечения поражения предстательной железы (и других раковых образований) – RECIST. За основу методики берутся аппаратные способы измерения размеров и определения местоположения очагов заболевания (УЗИ, КТ, МРТ или рентгенография). Активным развитием рака предстательной железы считается ситуация, когда размеры опухоли увеличиваются минимум на 20%, а также, когда она метастазирует в одну или более точек организма.
Рост показателя ПСА в течение первых 12 недель с момента начала химиотерапевтического лечения рака предстательной железы – это не оценочный критерий. Он становится актуальным лишь спустя 3 курса приёма препаратов.
Также в процессе лечения рака предстательной железы можно основываться на степень выраженности симптоматики (к примеру, по шкале боли). Один из весомых критериев эффективности для поражения предстательной железы с метастазированием в костную ткань – это облегчение болевого синдрома.
Если очевидный прогресс лечения рака предстательной железы посредством химиотерапевтических препаратов отсутствует, то количество курсов увеличивают до 6-10, либо до появления выраженного эффекта интоксикации. При очевидном росте очагов поражения переходят ко второй линии химиотерапевтического лечения.
Прогноз после химиотерапевтического лечения
При выявлении рака предстательной железы на этапе метастазирования обычно назначают гормональное лечение. В этом случае рост опухоли может быть замедлен (остановлен) на 2-3 года. Если же поражение предстательной железы гормонорезистентно, то используют химиотерапевтические средства, но при этом срок жизни может быть увеличен на 12-15 месяцев. Точный прогноз дать невозможно, т.к. всё зависит от индивидуальной реакции образования и организма пациента.
Обращение в Центр эндоваскулярной хирургии
В медицинском центре профессора Капранова вас ждёт высококвалифицированная помощь компетентных врачей-онкологов и сопутствующих специалистов. Тесное сотрудничество всех работников нашего учреждения гарантирует каждому пациенту разработку оптимального лечебного плана. Ответственный медицинский персонал обеспечивает комфортные условия пребывания на всех этапах обследования, лечения и реабилитации.
Внимательно изучайте разделы нашего сайта, чтобы иметь полное представление о возможностях и принципах работы медцентра. Также можно почитать или оставить собственные отзывы. В частности, мы будем рады конструктивной критике, которая поможет улучшить сервис.
Ценовая политика услуг центра является конкурентной. Стоимость обслуживания и лечения формируется индивидуально на основании особенностей патологии и потребностей пациента. Будьте здоровы!
Основные направления деятельности центра эндоваскулярной хирургии а также другие популярные материалы:
Эмболизация сосудов при лечении миомы матки
Цена проведения эмболизации миомы матки в Москве
Цена эмболизация артерий простаты при аденоме
Автор: Капранов С.А
Доктор медицинских наук, профессор, дважды Лауреат Государственных Премий Правительства Российской Федерации в области науки и техники, Лауреат Премии Ленинского Комсомола, автор более 350 научных работ по медицине, 7 монографий, и 10 патентов на изобретения по медицине
Лечение рака простаты (предстательной железы)
Заболевание диагностируется у 20% мужчин старше 50-ти лет, оперированных по поводу аденомы предстательной железы. Вероятность появления злокачественного новообразования с возрастом увеличивается, а возможность провести радикальное лечение рака простаты с выходом в стойкую ремиссию – уменьшается. В то же время, в любом возрасте прогноз успешности лечения напрямую зависит от того когда было обнаружено заболевание: чем раньше, тем больше шансов у больного на выздоровление.

В группу риска, прежде всего, попадают мужчины с наследственной (генетической) предрасположенностью, то есть те, у кого раком предстательной железы болел кто-либо из близких родственников.
Поэтому для мужчин старше 45 лет крайне важны профилактические обследования у онкоуролога, а также определение уровня ПСА (простатспецифического антигена) в крови – ежегодно и при появлении любых симптомов, характерных для данного заболевания.
Виды и стадии (степени) рака простаты
Формат и успешность лечения в онкологии зависят от стадии заболевания. Правильная терминология подразумевает вести речь, не о степени рака простаты, а стадии. Принято пользоваться общепринятой международной системой классификации TNM, позволяющей описать саму опухоль (T), состояние региональных лимфоузлов (N) и наличие или отсутствие отдаленных метастаз (M). Согласно этой системе выделяют 4 основных стадии.
Степень злокачественности определяют по шкале Глиссона (диапазон значений от 2 до 10) на основании данных микроскопического исследования биопсийной ткани. Чем меньше степень злокачественности, тем лучше прогноз. Чем ниже дифференцировка клеток новообразования, тем она злокачественнее. Чем больше размеры опухоли, тем больше в ней недифференцированных клеток. При постановке диагноза также учитывается значение ПСА.
- 1 степень (1 стадия) рака простаты характеризуется отсутствием видимых на УЗИ-исследовании очагов поражения. При пальпации (прощупывании) железы на этой стадии онкоуролог также не находит изменений. Диагноз выставляется по данным лабораторных исследований: тесту ПСА, биопсии.
- Лечение рака простаты 2 степени (2 стадии) также проводится исходя из того, что заболевание не выходит за пределы органа. Новообразование видно при ультразвуковом исследовании, однако оно занимает не более половины предстательной железы.
- Рака простаты 3 степени (3 стадии) характеризуется прорастанием опухоли за пределы капсулы (в семенные пузырьки). При этом прогноз при лечение рака простаты 3 степени относительно хороший, за счет того, что поражения других органов, лимфоузлов и отдаленные метастазы отсутствуют.
- При 4 степени (4 стадии) опухоль распространяется в другие органы и ткани: регионарные лимфоузлы, шейку мочевого пузыря, прямую кишку. Отдаленные метастазы чаще всего определяются в костях малого таза, позвоночнике, ребрах.
По своим морфологическим признакам злокачественные новообразования подразделяются на эпителиальные (плоскоклеточные, переходно-клеточные, аденокарциномы) и не эпителиальные.
Еще один критерий, учитывающийся при классификации, – зависимость роста опухоли от содержания в крови мужского полового гормона (тестостерона).
Основные методы лечения при раке предстательной железы
1 степень
Больным 1 стадии в возрасте до 70 лет при отсутствии противопоказаний к проведению операции показано хирургическое удаление новообразования. Прогноз выживаемости позитивный, большинство пациентов удается успешно излечить. Объем операции в данном случае минимальный, поэтому ее можно провести с помощью эндоскопа.
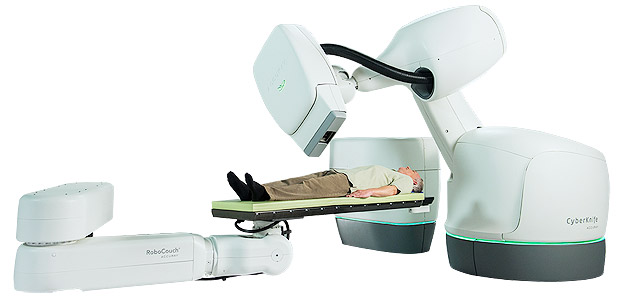
Лучевая терапия на системе Кибер-нож
При невозможности хирургического вмешательства из-за высокой степени риска для пациента в качестве альтернативного радикального лечения рака простаты может быть выбрано дистанционное радиохирургическая терапия Киберножом, гипофракционная терапия на системе TrueBeam или брахитерапия, реже – проведение курса лучевой терапии – стандартной конформной либо IMRT.
2 степень
Рак простаты 2 стадии предусматривает лечение любым из описанных выше способов описанных выше способов или их комбинацией. Прогноз по выживаемости положительный — до 80% стойкой ремиссии (отсутствие признаков возврата заболевания) в течение 5 лет. Хирургическое лечение, как правило на этом этапе проводится классическим способом (без эндоскопа). В процессе операции чаще всего удаляется не только сама железа, но часть семенников.
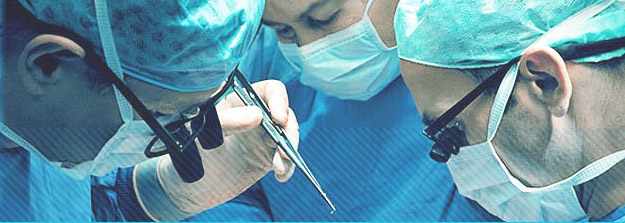
Криохирургическая операция
Еще один метод радикального воздействия – криохирургия (удаление опухоли путем разрушения с помощью локального замораживания жидким азотом). Опухоль также может разрушаться посредством действия высокоинтенсивного сфокусированного ультразвука.
3 и 4 степень
При обнаружении заболевания в поздних стадиях (3, 4) проводится комплексная терапия, объем и содержание которой определяются в индивидуальном порядке. Относительно других видов рака процент выходящих в ремиссию высокий.
На всех стадиях заболевания больному может быть назначена гормонотерапия, реже – химиотерапия вследствие ее низкой эффективности и высокого риска развития осложнений.
В некоторых случаях онкоурологи отказываются от любых способов лечения рака простаты, выбирая тактику активного наблюдения. Прежде всего, это касается престарелых мужчин с низкой степенью злокачественности новообразования, наличие которой не сказывается на качестве жизни больного.
Лечение гормонозависимого рака
Раковые клетки гормонозависимых опухолей активно растут и размножаются при избытке тестостерона, поэтому такие новообразования лечатся с применением гормонотерапии (медикаментозной кастрации) или удалением яичек (классической кастрации).
Гормонотерапия проводится с помощью препаратов, блокирующих рецепторы к тестостерону раковых клеток или снижающих выработку самого гормона. При терапии гормонорезистентной (гормононезависимой) онкологии эти методы неэффективны. По мере прогрессирования болезни гормонозависимость опухоли уменьшается.
Последствия лечения рака простаты у мужчин
Одно из наиболее психотравмирующих осложнений у мужчин в возрасте до 60-ти лет – высокая вероятность импотенции, которая после хирургического вмешательства, гормональной терапии и конформной лучевой терапии развивается в 35-50% случаев.
После радиохирургической терапии Киберножом риск развития импотенции минимален. Результаты метода сопоставимы с результатами стандартной операции, при этом лечение полностью бескровно и атравматично, что исключает необходимость наркоза и риск инфицирования.
Контактная лучевая терапия (брахитерапия) с использованием современного оборудования также обычно не вызывает значимых нарушений эректильной функции.
Помимо импотенции, в отдаленном периоде после курса классической ЛТ при облучении обширных зон могут возникать такие осложнения, как проктит (воспаление прямой кишки) или цистит (воспаление мочевого пузыря).
Характер и выраженность осложнений после химиотерапии обуславливается типом используемых препаратов, интенсивностью терапии и индивидуальными особенностями организма пациента.
Негативные последствия у мужчин старше 70 — 80 лет возникают чаще и протекают тяжелее, что принимаются во внимание при выборе методов и препаратов. Вероятность возникновения осложнений зависит от наличия сопутствующих диагнозов и состояния естественной иммунной защиты.
Восстановление
Полное восстановление у мужчин после лечения рака простаты при отсутствии осложнений занимает до 2-3 месяцев. При этом после операции первые 3-4 недели пациент находится в стационаре. Восстановление после терапии Кибер-ножом и брахитерапии обычно не требует пребывания в клинике дольше 5 дней. Гормональная терапия и химиотерапия может проводиться амбулаторно.
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.
Рак предстательной железы: почему возникает, симптоматика, методы диагностики и лечения
Согласно данным множества исследований, отмечается неуклонный рост случаев обнаружения первичного рака предстательной железы (РПЖ). В России это заболевание находится на 4-м месте среди всей онкологии, выявляемой во время профосмотров. Опережает его рак шейки матки, молочной железы и губы. В западных странах рак простаты составляет 25% от всех онкологических заболеваний.
Что такое рак простаты?
РПЖ представляет собой злокачественное новообразование, которое развивается из тканей предстательной железы.
Предстательная железа, или простата, – мужской репродуктивный орган, по размерам схожий с каштаном. Он находится под мочевым пузырем и охватывает передний отдел мочеиспускательного канала.
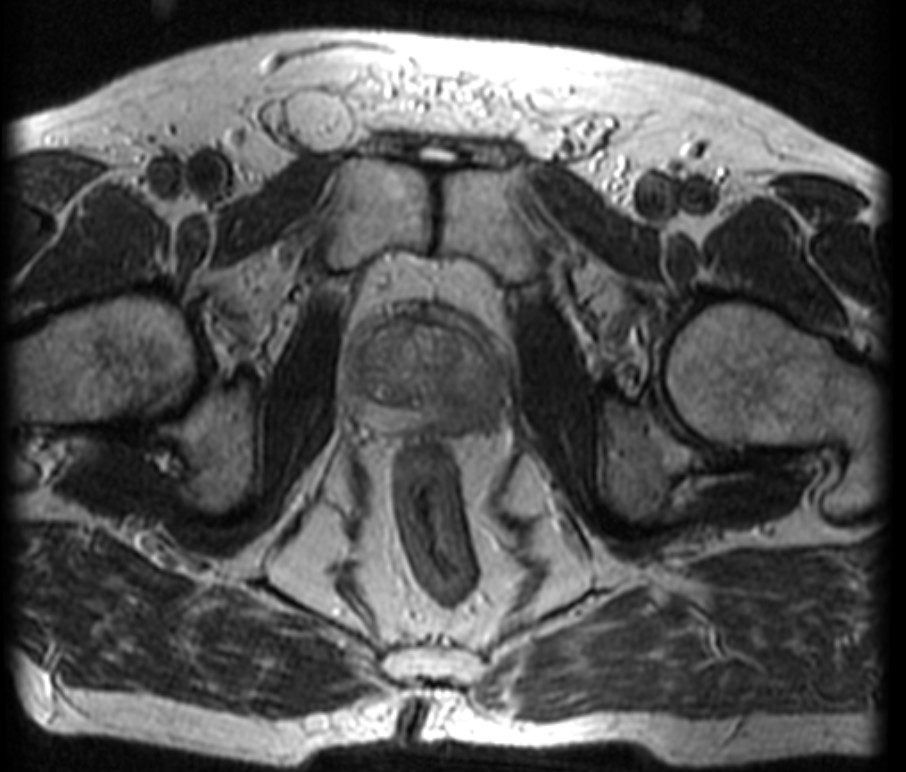
Рис. 1. МРТ (Т2-взвешенные изображения) картина поражения левой доли предстательной железы.
Разновидности рака предстательной железы
В 95% случаев РПЖ развивается из эпителиальных клеток собственных желез (их называют «ацинусы»), из которых сформирована периферическая часть предстательной железы. Эта форма болезни называется «ацинарная аденокарцинома». В остальных 5% случаев диагностируется интрдуктальная разновидность, для которой характерно более агрессивное течение.
Важная характеристика аденокарциномы – степень ее дифференцировки, которая выявляется при гистологическом исследовании биоптата или биоматериала, полученного в ходе операции. Дифференцировка сегодня выражается шкалой Глисона (Gleason), в соответствии с которой присваивается сумма баллов: от 6 (самый благоприятный прогноз) до 10 (самый неблагоприятный вариант).
Характерные признаки заболевания
Риск развития РПЖ растет с возрастом: средний показатель в этой категории заболевших – 68 лет. Существуют также факторы риска, то есть то, что повышает шанс появления онкологического заболевания. Современной медициной не выявлены достоверные факторы, которые приводят к повышению риска развития РПЖ (какие-либо препараты, характер рациона, вредные привычки, плохая экология и др.). Поэтому основным фактором остается возраста, а также возрастной гормональный дисбаланс (между эстрогенами и андрогенами).
Симптоматика, первые признаки
На ранних стадиях злокачественная опухоль обычно не проявляет себя. Кроме аденокарциномы, у людей с повышенным риском развития РПЖ почти всегда присутствуют сопутствующие патологии (простатит, аденома простаты), и они могут давать симптоматику. Чаще всего встречаются следующие симптомы:
- частое мочеиспускание, включая ноктурию (то есть учащение позывов в ночное время);
- трудности при мочеиспускании;
- ощущение, что мочевой пузырь опорожнен не полностью;
- боль при мочеиспускании;
- гематурия, то есть кровяные включения в моче;
- гемоспермия – при эякуляции наличие примесей крови в сперме;
- костные боли, появляющиеся при метастазировании РПЖ в скелет.
Таким образом, чем выше стадия, тем больше вероятность проявления симптоматики. Чаще всего РПЖ обнаруживается во время профилактического обследования (оно рекомендовано всем мужчинам старше 40-ка лет). Такое обследование включает в себя:
-
;
- пальцевое ректальное исследование;
- определение ПСА (простат-специфического антигена).
ПСА – это маркер, используемый для раннего выявления РПЖ. Он достаточно чувствителен и специфичен, чтобы заподозрить наличие рака на начальной стадии. Кроме ПСА, анализу могут подвергаться его производные – индекс здоровья простаты, плотность ПСА, соотношение свободного ПСА и общего.
Методы диагностики
Основа диагностики РПЖ – биопсия предстательной железы, иными словами, морфологическая верификация.
Показания к биопсии:
- Уровень ПСА выше нормального. Следует отметить, что верхняя граница нормы (4 нг/мл) может быть понижена для относительно молодых мужчин (возраст 40-50 лет) до 2-2,5 нг/мл.
- Подозрительные изменения очагового характера (гипоэхогенные очаги), выявленные при УЗИ (или ТРУЗИ) либо МРТ. Сейчас рекомендуется делать биопсию после МРТ, а не до нее, потому что это улучшает толкование изменений. Важно: делать МРТ лучше в специализированном учреждении, специалисты которого имеют нужный опыт, а диагностическое оборудование – специализированное ПО (то есть мультипараметрическая МРТ).
- Обнаруженные в ходе пальцевого исследования очаговые изменения.
Важно! Если уровень ПСА ниже верхней допустимой границы, это не всегда говорит о том, что РПЖ отсутствует. Примерно 25% случаев заболеваемости отмечаются на фоне нормальных значений этого показателя. Поэтому решение о необходимости проведения биопсии должно приниматься после комплексного обследования, которое включает все виды диагностики.
Варианты биопсии простаты:
- Стандартная, или трансректальная мультифокальная. Такая биопсия делается обычно амбулаторно. Выполняется через прямую кишку, в ходе процедуры берут не менее 6-ти биоптатов (лучше 10-12). Недостаток этого вида биопсии – вероятность пропустить РПЖ, если он имеет малые размеры и локализуется в определенных зонах предстательной железы.
- Промежностная. Проводится обычно по расширенной методике (сатурационная процедура). В ходе нее беру гораздо больше биоптатов – от 20-ти. Такая биопсия показана тем, кому проводились стандартные биопсии, но они не выявили РПЖ, при этом риск развития заболевания сохраняется. Еще одно показание: планирование органосохраняющего лечения (фокальная терапия, брахитерапия). Недостатки методики – необходимость обеспечения пациенту спинальной анестезии, использования специализированного оборудования, стационарные условия проведения. Однако именно такая биопсия дает возможность наиболее точно выявить характер патологических изменений.
- Fusion. Это современная разновидность биопсии предстательной железы, при которой используется современное оборудование и данные МРТ, проведенной заблаговременно. Широкое применение такой методики сейчас ограничено ввиду отсутствия в лечебных учреждениях нужного оборудования.
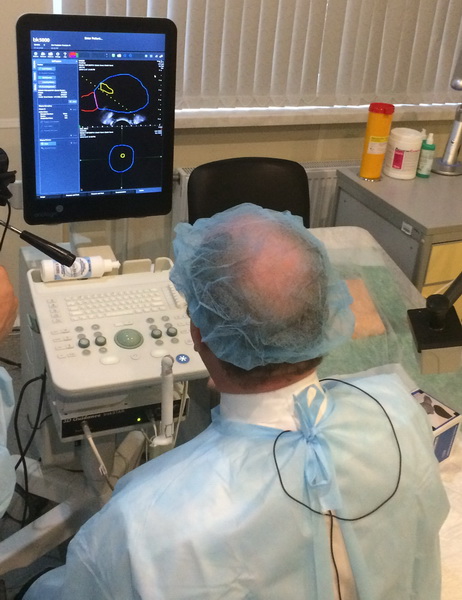
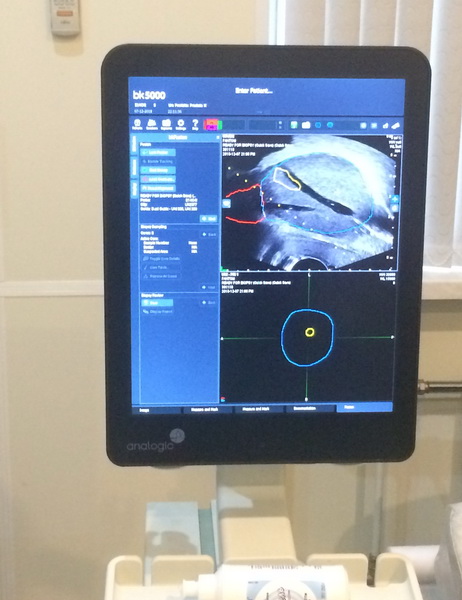
Рис. 2 А., 2 Б. Фьюжн-биопсия. Мастер-класс в НМИЦ онкологии им. Н.Н. Петрова
Стадии рака предстательной железы
Стадирование РПЖ и определение группы риска рецидивирования после возможной терапии производятся после гистологической верификации заболевания.
Стадирование при стандартном подходе подразумевает остеосцинтиграфию и МРТ органов малого таза. Магнитно-резонансная томография нужна, чтобы выявить степень локального распространения процесса в зоне простаты (прорастание в семенные пузырьки, выход новообразования за капсулу железы), а также определить, есть ли поражение регионарных лимфоузлов.
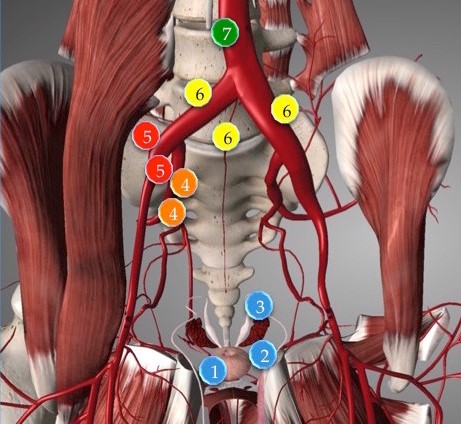
Рис. 3. Пути распространения рака предстательной железы в лимфоузлы таза.
В случае необходимости дополнительно проводится КТ органов груди или брюшной полости.
Цель проведения остеосцинтиграфии – выявление возможного поражения опухолью костей скелета.
Могут назначиться дополнительные исследования – рентгенография (прицельная), УЗИ, урофлоуметрия.
Группа риска определяется, исходя из уровня ПСА на момент до начала терапии, суммы Глисона, согласно данным биопсии, и клинической стадии болезни. Группа риска может быть низкой, промежуточной и высокой. Ее определение крайне важно, чтобы выбрать оптимальный метод лечения.
ПСА от 10 до 20 нг/мл
ПСА более 20 нг/мл
сумма Глисона 6
сумма Глисона 7
сумма Глисона 8-10
Методики лечения
В соответствии с результатами многоцентрового проспективного рандомизированного исследования ProtecT (2016) лучевая терапия и хирургическое лечения демонстрируют раную противоопухолевую эффективность и обеспечивают надежный контроль над заболеванием у большинства (более 90%) больных раком предстательной железы с низким и промежуточным риском рецидива заболевания. В настоящее время решающим фактором при выборе противоопухолевого лечения у этой категории больных является безопасность терапии и снижение риска осложнений.
Рассмотрим основные виды терапии: хирургическое лечение, брахитерапия, стереотаксическое облучение, сочетанная лучевая терапия.
Хирургическое вмешательство
РПЭ, или радикальная простатэктомия, представляет собой хирургическое вмешательство по удалению предстательной железы, а также окружающей клетчатки и лимфоузлов. При такой операции с железой единым блоком удаляют семенные пузырьки и участок канала уретры.
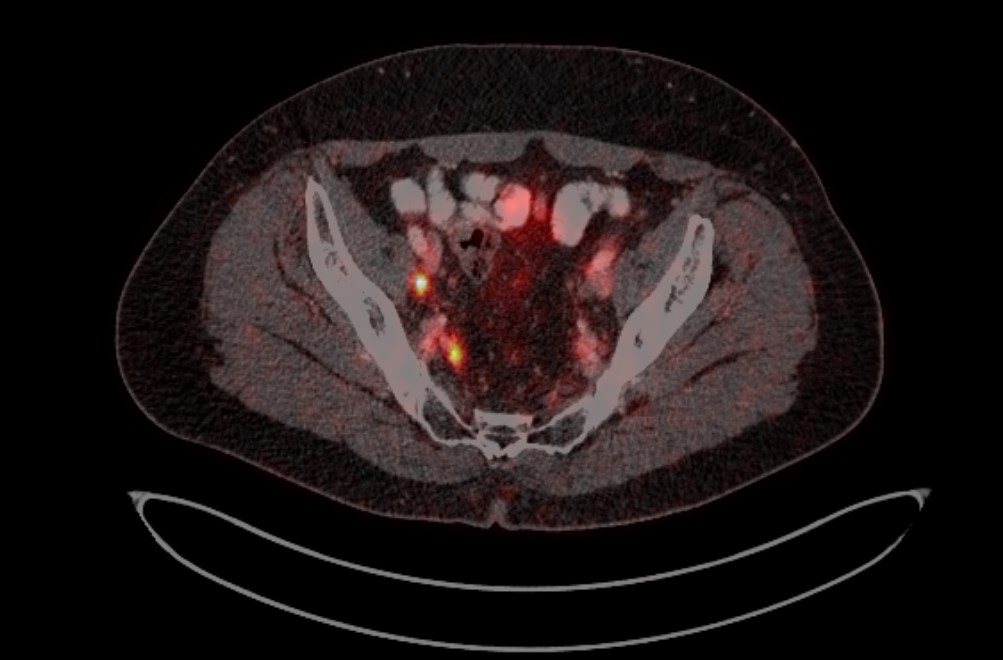
Рис. 4. ПЭТ-КТ изображения больного М. с поражением тазовых лимфоузлов
РПЭ различается по виду доступа и степени инвазивности:
- Открытая. Проводится двумя основными видами доступа: промежностным и позадилонным.
Позадилонный доступ предполагает разрез в нижней части живота, через который удаляется простата и местные ткани.
Промежностная методика – это открытый способ, при котором небольшой надрез делается в зоне между анусом и кожно-мышечным мешком, то есть мошонкой. Методика позволяет удалить простату, но при ее применении нельзя также удалить неблагоприятные ткани и узлы, расположенные около железы. Если после проведения промежностной операции в органах малого таза обнаружатся раковые клетки, нужно будет дополнительно делать лимфаденэктомию. Сейчас промежностная методика применяется крайне редко.
- Лапароскопическая. Основные доступы: через предбрюшинное пространство или брюшную полость. Для выполнения операции делается несколько небольших разрезов на передней стенке живота. Через них в предбрюшинное пространство или брюшную полость вводят специальные манипуляторы и удаляют предстательную железу, жировую клетчатку малого таза, а также регионарные лимфатические узлы.
Лапароскопическая методика – наиболее щадящая. Врач имеет доступ к пораженному органу через маленький разрез внизу живота. В него вводится камера и все нужные хирургу инструменты. Камера подает на экран изображение органов малого таза, благодаря чему врач полностью контролирует процесс, а пациент получает минимум вреда. При таком способе минимизированы кровопотери, посторонние органы почти не травмируются, эректильная функция сохраняется частично или полностью и т. д.
Рассмотрим также наиболее распространенные осложнения, которые могут возникнуть после операции на простате:
- Недержание мочи. Это осложнение возникает в 95% случаев сразу после снятия с мочевого пузыря пациента специального катетера. Далее в 45% случаев это осложнение проходит через 6 месяцев после удаления РПЖ. В 15% случаев недержание сохраняется до 1 года.
- Потеря эректильной функции – полная или частичная. Существенно снизить такое осложнение врачам удается при проведении лапароскопической простатэктомии. При такой методике минимизировано повреждение нервных стволовых клеток органов малого таза. Если после хирургического вмешательства наблюдается расстройство эректильной функции, то пациенту прописывается курс медикаментозной терапии и наружных препаратов, расширяющих сосуды.
Брахитерапия
Брахитерапия представляет собой введение в ткани источников излучения. Эта методика – самая «молодая» среди способов лечения РПЖ. Сегодня это один из наиболее востребованных методов облучения простаты, обеспечивающий очень высокую избирательность подведения дозы. Основная особенность брахитерапии заключается в том, что простата облучается изнутри – источник облучения вводится непосредственно в нее. Такой метод дает возможность применять высокие дозы (100-140 Гр и более), при этом избегая высокого риска лучевого поражения не подверженных раку тканей.
Стремительный рост клинического применении брахитерапии, по сравнению с хирургическими вмешательствами, обуславливается высокой эффективностью, которая сопоставима с простатэктомией, при гораздо более низкой частоте возникновения осложнений.
Различают 2 вида брахитерапии, в зависимости от способа введения источника излучения в железу и его мощности:
- высокомощная, для которой характерно кратковременное введение источника излучения высокой мощности в ткани;
- низкомощная – источник низкой мощности устанавливается на все время лечения.
При проведении низкомощностной брахитерапии в ткани простаты вживляется источник излучения и остается в них до полного распада. Долгое время при РПЖ именно этот вид брахитерапии применялся чаще всего. Наиболее часто для выполнения терапии используется изотоп радиоактивного йода, то есть I125.
Согласно многочисленным исследованиям, брахитерапия низкой мощности обеспечивает не очень высокую точность облучения. Это объясняется смещением источника излучения, изменением формы и размеров простаты, затрагиванием прилежащих здоровых органов. Ввиду этого низкомощностная методика показана в основном пациентам с самыми начальными стадиями, когда опухоль небольшая и не выходит за пределы железы. Такая брахитерапия имеет и другие существенные недостатки. Первый – это высокая частота осложнений, возникающих со стороны мочевыводящих путей, может даже возникнуть острая задержка мочи и необходимость эпицистостомы, то есть формирования надлобкового мочепузырного свища, на долгий срок. В основе осложнений – отек предстательной железы из-за того, что в ней остается несколько сотен зерен (инородных тел). Кроме того, радиоактивные зерна, если они долго находятся в организме, представляют собой источники излучения, представляющие определенную опасность для других людей. Из-за этого контакт пациента с родными ограничен (нельзя близко общаться с маленькими детьми).
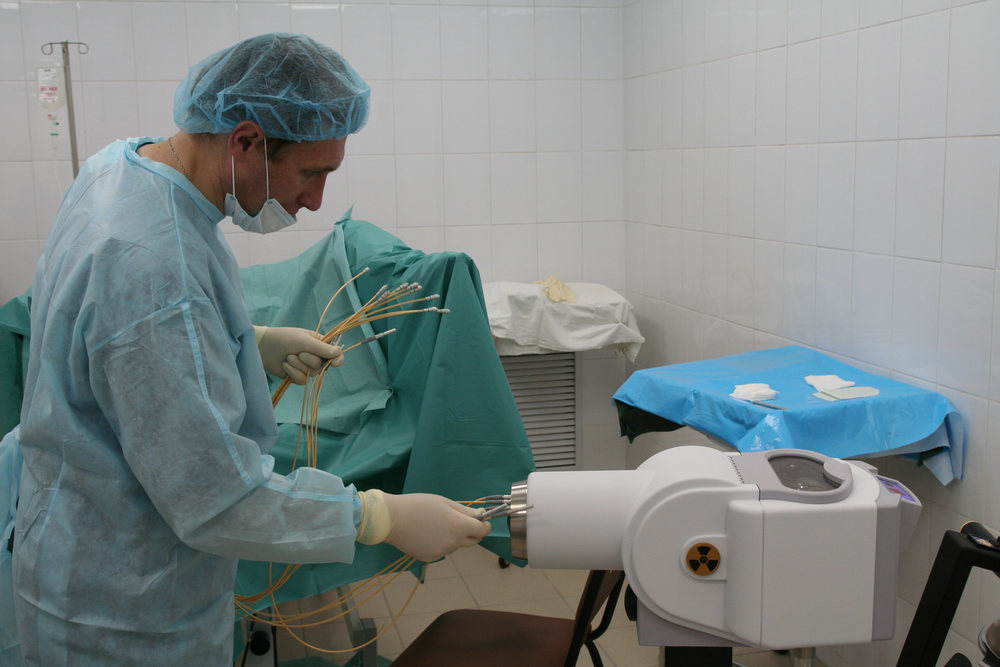
Рис. 5. Высокомощностная (высокодозная) брахитерапия
Самая современная методика внутритканевой терапии – высокомощностная брахитерапия. Источники излучения автоматически загружаются и извлекаются. Эта лучевая терапия обладает принципиальным плюсов – высокой точностью облучения, достигаемой путем введения игл под контролем специального УЗ-аппарата. Одновременно в автоматическом режиме рассчитываются дозы и возможность быстрой корректировки плана лучевого лечения. Источник излучения находится в организме пациента временно, поэтому уровень осложнений – самый низкий, по сравнению со всеми радикальными методиками терапии РПЖ, включая низкодозную разновидность брахитерапии.
Технологические особенности методики позволяют предлагать ее большинству больных, вне зависимости от размеров злокачественного новообразования и его распространенности за пределы простаты. Кроме того, высокомощностная брахитерапия – это «золотой стандарт» при комбинированном лечении, то есть одновременном использовании с дистанционным облучением у больных с неблагоприятными характеристиками новообразования.
Самый большой недостаток высокомощностной методики – высокие требования, касающиеся квалификации медицинского персонала, а также необходимость использования высокотехнологичного оборудования. Этим объясняется малая распространенность метода в России.
Противопоказания к брахитерапии подразделяются на общие и урологические. Самые частые урологические противопоказания – это серьезные нарушения процесса мочеиспускания:
- IPSS (индекс опросника качества мочеиспускания) более 20-ти;
- объем остаточной мочи более 50-ти мл;
- самая высокая скорость мочеиспускания, зарегистрированная при урофлоуметрии, – до 10 мл/сек;
- проведенная трансуретральная резекция мягких тканей предстательной железы менее чем за 9 месяцев до предполагаемой брахитерапии.
Нужно отметить, что большой объем простаты, который имеет значение для низкодозной брахитерапии (50-60 см 3 ), почти не ограничивает возможности лечения в режиме высокомощностной методики.
- отдаленные метастазы;
- злокачественные опухоли, инфекции и воспаления мочевого пузыря;
- злокачественные опухоли, инфекции и воспаления прямой кишки;
- непереносимость анестезии;
- отсутствие прямой кишки ввиду предшествующих операций.
Данные противопоказания относятся не только к брахитерапии, но и к другим методикам лучевой терапии РПЖ.
Стереотаксическое облучение
СТЛТ (стереотаксическая лучевая терапия) – высокоточная методика лечения очага РПЖ высокими дозами ионизирующего излучения.
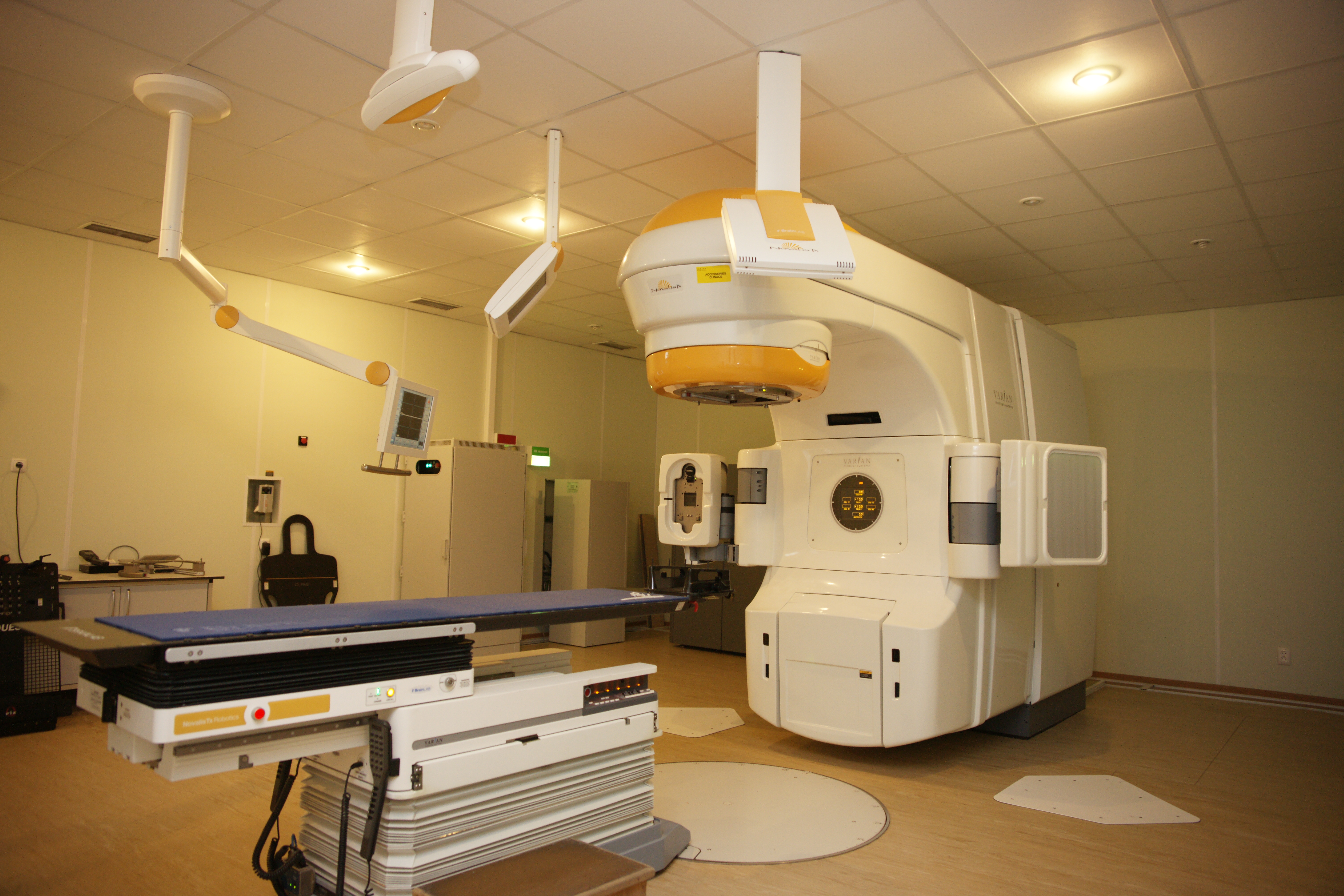
Рис. 6. Стереотаксический лучевой ускоритель
Сегодня СТЛТ при раке простаты реализуется несколькими основными методами, каждый из которых обладает своими особенностями, плюсами и минусами:
Лечение рака простаты
Существуют разные виды лечения рака предстательной железы (РПЖ) у мужчин, врач выбирает тактику с учетом ряда факторов. В первую очередь ориентируются на стадию опухоли. Если она не выходит за пределы предстательной железы, возможно хирургическое лечение. Если имеются метастазы в лимфатических узлах, костях и других органах, хирургическое лечение не приведет к выздоровлению.
Также необходимо учитывать сопутствующие проблемы со здоровьем, а они, как правило, имеются, потому что злокачественные опухоли предстательной железы чаще диагностируются у мужчин пожилого возраста. Такие пациенты часто страдают артериальной гипертензией, имеют в анамнезе перенесенный инсульт или инфаркт. В таких случаях операция часто бывает противопоказана. [3]
Диагностика рака простаты
Чаще всего на начальных стадиях РПЖ симптоматика отсутствует, т.к. поражаются периферические отделы. По мере прогрессирования заболевания может возникать ослабление или прерывистость струи мочи, учащение мочеиспускания, ощущение неполного опорожнения мочевого пузыря, может возникать примесь крови в моче или сперме, эректильная дисфункция, боль в промежности, костях или пояснице, анемия, отек нижних конечностей и др.
Диагностика рака простаты включает следующие методы: [1]
- Пальцевое ректальное исследование. Это обязательный метод диагностики опухолей предстательной железы, при этом он самый простой, безопасный и дешевый. Его результаты определяются размером опухоли, ее локализацией, а также квалификацией доктора. [9]
- Лабораторная диагностика – определение простатспецифического антигена в крови. При его концентрации 2,5-10 нг/мл чаще выявляется доброкачественная гиперплазия предстательной железы, а при значении выше 10 нг/мл более вероятен РПЖ. Хотя стоит отметить, что это все достаточно условно, его норма зависит от возраста пациента, а также при постановке диагноза учитывается соотношение свободного к общему ПСА (для злокачественного новообразование это значение ниже 0,1), а также исследуется маркер PCA3.
- Инструментальные методы, которые включают трансректальное ультразвуковое исследование, магнитно-резонансную томографию, компьютерную томографию, рентгенографию, остеосцинтиграфию. Подтверждается диагноз только после гистологического исследования биопсийного материала.
Каждый диагностический метод имеет свои показания к проведению. В одних случаях достаточно определения ПСА и пальцевого ректального исследования. В других может дополнительно потребоваться проведение КТ и биопсии. Точный план лечения определяется с учетом состояния пациента и наличия у него тех или иных симптомов. [3]
Современные методы лечения рака простаты
Лечение при онкологии простаты может включать хирургическое вмешательство, лучевую терапию, химиотерапию, гормональную терапию. Кроме того, сегодня набирает популярность абляция предстательной железы с помощью высокоинтенсивного сфокусированного ультразвука – так называемый HIFU (High Intensity Focused Ultrasound). В некоторых случаях врач придерживается тактики активного наблюдения. [1]
Активное наблюдение
У некоторых мужчин в силу возраста или сопутствующих проблем со здоровьем лечение может привести к осложнениям и побочным эффектам, которые бывают более серьезны, чем проблемы, создаваемые самим раком. В таких случаях врач может придерживаться активного наблюдения. Такая тактика возможна в следующих случаях:
- Пациент не испытывает симптомов.
- По прогнозам опухоль будет расти медленно.
- Опухоль имеет небольшие размеры.
- Рак не распространяется за пределы предстательной железы.
Тактика активного наблюдения предполагает осмотры врача и анализы крови на простатспецифический антиген каждые полгода. Раз в год врач может назначить биопсию простаты. [1]
Хирургическое лечение рака предстательной железы
При раке простаты выполняют радикальную простатэктомию — операцию, во время которой удаляют предстательную железу и окружающие ткани, включая семенные пузырьки.
Радикальная простатэктомия может быть выполнена разными способами:
- Позадилобковую простатэктомию выполняют через продольный разрез от пупка до лобка. Обычно пациента выписывают из клиники через несколько дней после операции, восстановительный период продолжается несколько недель.
- При промежностной простатэктомии делают дугообразный разрез между мошонкой и анусом. Эта операция более быстрая по сравнению с позадилобковой простатэктомией, но во время нее затруднен доступ к лимфатическим узлам, и она чаще приводит к проблемам с эрекцией.
- Лапароскопическая простатэктомия выполняется с помощью специальных инструментов через проколы в брюшной стенке. Она сопровождается меньшим кровотечением и меньшей травматизацией тканей по сравнению с открытыми вмешательствами, укорачивается восстановительный период. Но риск осложнений примерно тот же.
- Роботизированная простатэктомия проводится с применением робота да Винчи. По сути это то же лапароскопическое вмешательство, но хирург держит инструменты не сам, а управляет движениями робота через специальный пульт. Благодаря этому движения инструментов более точные. Но нет доказательств того, что это помогает снизить риск осложнений.

Возможные осложнения после радикального удаления простаты: недержание мочи, эректильная дисфункция, небольшое укорочение полового члена, паховая грыжа, бесплодие, лимфедема (отек из-за удаления лимфатических узлов). [1,2]
Виды лучевой терапии при раке простаты
Лучевая терапия РПЖ может быть назначена в качестве альтернативы хирургическому лечению. По эффективности она зачастую не уступает операции. Другие показания:
- В сочетании с гормональной терапией при раке, который распространился за пределы предстательной железы.
- При рецидиве рака.
- В качестве паллиативного лечения на поздних стадиях. Это помогает сдержать рост опухоли и увеличить продолжительность жизни пациента.

При раке простаты применяют два вида лучевой терапии: дистанционную (внешнюю) и внутритканевую лучевую терапию (брахитерапию). [1,5]
Дистанционная лучевая терапия
Наиболее распространенный способ дистанционной лучевой терапии рака предстательной железы – фотонное облучение. Суммарная очаговая доза составляет 65-70 Гр, на тазовые лимфатические узлы – 45-50 Гр (при низком риске метастазирования не проводится), а разовая доза облучения – 1,8-2,0 Гр.
Внешнее облучение бывает разных видов:
- Трехмерная конформная лучевая терапия использует компьютерные технологии, чтобы определить точное местоположение предстательной железы и опухоли. Это помогает уменьшить повреждение окружающих здоровых тканей.
- Интенсивно-модулированная лучевая терапия — более совершенная разновидность 3D-конформной лучевой терапии. Аппарат не только облучает опухоль под разными углами, но и регулирует интенсивность излучения. Это позволяет подавать на простату еще большую дозу, избегая облучения здоровых тканей.
- Стереотаксическая терапия использует современные технологии, чтобы доставить всю дозу излучения туда, где находится злокачественная опухоль. Она позволяет сократить курс лучевой терапии, в итоге он продолжается дни вместо недель.
К преимуществам дистанционной лучевой терапии рака простаты относится то, что возможно полное излечение заболевания, не требуется госпитализация – лечение может быть проведено амбулаторно, а также оно позволяет избежать хирургического вмешательства. [1]
Брахитерапия
При брахитерапии небольшую гранулу, которая является источником излучения, помещают непосредственно в предстательную железу. Этот метод лечения применяется у мужчин на ранних стадиях, при которых наблюдается медленный рост.
В настоящее время используются 2 разновидности брахитерапии при РПЖ:
- Постоянная (низкодозная). Применяется изотоп йода – 125I или палладия – 103Pd.
- Временная (высокодозная). Применяется изотоп ирридия – 192Ir. Используется при местнораспространенных опухолях в сочетании с дистанционной лучевой терапией.
Как правило, брахитерапия используется на стадиях Т1с-Т2b, при уровне ПСА менее 10 нг/мл, сумме Глисона менее 7 и объеме предстательной железе до 50 см3. Среди ее преимуществ можно отметить то, что это однократная амбулаторная процедура, дает результаты аналогичные хирургическому лечению, сопровождается более низким риском развития недержания мочи, а также дает высокие шансы сохранить потенцию.
На более поздних стадиях брахитерапию иногда применяют в сочетании с дистанционной лучевой терапией. [1]
HIFU для лечения РПЖ
Метод HIFU является достаточно новым в лечении РПЖ, и основан он на применении высокоинтенсивного сфокусированного ультразвука, воздействие которого позволяет разрушать заданный объем предстательной железы, не повреждая при этом окружающие ткани. Метод не увеличивает вероятность метастазирования из первичного очага, а также может использоваться после хирургического вмешательства и после лучевой терапии. [1,7]
На сегодняшний день уже опубликованы исследования, в которых демонстрируется эффективность HIFU-терапии при 3-летнем наблюдении на уровне 91%. При этом в группе с низким риском прогрессии эта цифра превышает 95%, а в группе с высоким риском (при местнораспространенном РПЖ) она составляет 80%. Проведение HIFU-терапии сопровождалось низкой частотой побочных эффектов, а большинство пациентов отмечали улучшение качества жизни. [6,8]
Химиотерапия при раке простаты
Химиотерапия не является основным методом лечения рака предстательной железы, но иногда она может быть полезна. Химиопрепараты назначают в сочетании с гормональными препаратами или в случаях, когда гормональная терапия не работает.
При раке простаты применяют препараты: доцетаксел, кабазитаксел, митоксантрон, эстрамустин. [2,4]
Гормональная терапия при раке простаты
Известно, что мужские половые гормоны — андрогены — стимулируют рост рака предстательной железы. Цель гормональной терапии состоит в том, чтобы снизить уровень андрогенов в организме или не допустить их взаимодействия с раковыми клетками.
Гормональная терапия останавливает рост опухоли на некоторое время. В качестве монотерапии она не способна вылечить. Показания к ее назначению: [4]
- Наличие противопоказаний к хирургическому лечению и лучевой терапии.
- Распространенный рак простаты, когда операция и лучевая терапия неэффективны.
- При агрессивных опухолях, когда высок риск рецидива, гормональную терапию назначают вместе с лучевой терапией.
- Ее могут назначить и до лучевой терапии, чтобы затормозить рост опухоли и улучшить результаты лечения.
Лечение рака простаты постоянно совершенствуется. Совсем недавно в результате крупного исследования было доказано негативное воздействие гормональной терапии пациентам с рецидивирующим процессом и низким уровнем ПСА. Врачи «Евроонко» внимательно следят за подобными изменениями и предлагают своим пациентам только то лечение, которое отвечает современным стандартам.
Лечение рака простаты 4 стадии
При IV стадии рак простаты распространяется на мочевой пузырь, прямую кишку, лимфоузлы, появляются удаленные метастазы в костях и различных органах. Но даже на этой стадии, в зависимости от распространенности процесса, иногда можно добиться ремиссии. В случаях, когда рак неизлечим, паллиативное лечение поможет на некоторое время сдержать его рост и продлить жизнь больного.
Обычно лечение рака предстательной железы 4 стадии включает следующие мероприятия: [1,2]
- Гормональная терапия, в некоторых случаях — в сочетании с химиотерапией.
- Хирургическое лечение. Если рак не распространился на лимфоузлы, и нет удаленных метастазов, можно провести радикальную простатэктомию. В других случаях для борьбы с симптомами прибегают к паллиативному вмешательству — трансуретральной резекции простаты (ТУРП).
- Если пациенту противопоказаны все виды лечения, и у него нет выраженных симптомов, возможно активное наблюдение.

Лечение метастазов рака простаты в кости
Если обнаружены метастазы в костях, назначают гормональную терапию, лучевую терапию, химиотерапию. Кроме того, в лечении метастаз в кости при раке простаты применяют бисфосфонаты (препараты, которые замедляют разрушение кости), деносумаб (тот же эффект, что у бисфосфонатов, но другой механизм действия), препараты гормонов коры надпочечников (уменьшают боли), обезболивающие средства. [4]
Обзор современных методов лечения рака простаты, плюсы и минусы
Благодаря широкому внедрению скрининговых методов исследования, большинство вновь диагностированных случаев онкологии простаты обнаруживаются на начальных стадиях, когда распространение рака ограничивается объёмом железы. Последние достижения в медицине, сделали возможным лечение рака предстательной железы 1, 2 и 3 стадии без операции. Ниже рассмотрены методы диагностики и лечения опухоли простаты у мужчин.
Что такое рак простаты?
Простата – это мужская половая железа, расположенная в нижней части таза, размером примерно с грецкий орех. Этот орган производит особую жидкость, которая является компонентом спермы у мужчин. Рак предстательной железы – это опухоль, возникающая в результате роста патологических клеток. Рак простаты – наиболее распространённая форма онкологии у мужчин, после рака кожи, и является третьей по частоте причиной смертности от онкологических заболеваний.
Как выявить рак простаты?
Рак предстательной железы, как правило, обнаруживается с помощью теста на простат-специфический антиген (ПСА / PSA), при котором оценивают уровень содержания в крови определенных протеинов. Дополнительно проводится пальцевое ректальное исследование, во время которого врач обследует любые увеличенные, твёрдые или неправильной формы участки в простате.
При обнаружении повышенного уровня ПСА или изменений в предстательной железе, доктор назначает биопсию. Чтобы точно направить иглу для взятия образца, во время этой процедуры используется трансректальное ультразвуковое исследование (ТРУЗИ). Биопсия простаты обычно проводится урологом под местной анестезией. Образец биопсии затем отправляется в лабораторию и исследуется патологоанатомом, который специализируется на диагностике заболеваний путём изучения тканей, крови и жидкостей организма.
Если клетки рака присутствуют в образце биопсии, то для определения стадии рака назначаются дальнейшие исследования, такие как компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ-КТ) с холином или галлием, или сканирование костей.
Как лечить рак простаты?
Для пациентов с раком простаты, выявленным на ранней стадии, когда опухоль локализована в пределах железы, применяют следующие современные методы лечения:
- Стандартное хирургическое вмешательство (радикальная простатэктомия)
- Роботизированная простатэктомия на апарате да Винчи
- Дистанционная лучевая терапия (ДЛТ)
- Брахитерапия
- Стереотаксическая радиотерапия (SBRT)
- Гормональная терапия
- Активное наблюдение
Каждый из этих вариантов подробно описан ниже, с данными по результатам лечения. После лечения систематически измеряется уровень ПСА. Его повышение может свидетельствовать о возможном рецидиве рака. Снижение уровня ПСА свидетельствует об эффективности лечения. Кроме того, пациенты периодически обследуются на предмет осложнений после лечения (так называемая постлучевая токсичность). Осложнения оцениваются по шкале от 1 до 5, где 1-2 класс осложнений считается незначительными, 3 – умеренными, а 4-5 классы – серьёзными осложнениями.
Оперативное лечение рака простаты
Хирургия рака простаты предусматривает полное удаление предстательной железы с частью окружающих тканей (радикальная простатэктомия). Есть два вида операций при раке простаты: открытая радикальная простатэктомия и лапароскопическая простатэктомия.
Открытая радикальная простатэктомия
Есть два подхода к выполнению открытой радикальной простатэктомии: радикальный позадилонный и радикальный промежностный.
Во время радикальной позадилонной простатэктомии хирург удаляет всю простату и прилегающие ткани через длинный надрез в нижней части живота. При этом могут быть повреждены окружающие нервы, что часто приводит к импотенции. Врачи используют специальные методы, чтобы сохранить близлежащие нервы, контролирующие эрекцию. Их использование уменьшает вероятность развития импотенции после операции. Но риск ее развития по-прежнему существует.
Во время радикального промежностного подхода хирург делает надрез кожи в промежности, между яичками и анусом. При таком подходе сохранить нервы еще труднее. Пациенты, которым проводится открытая радикальная простатэктомия, обычно проводят в больнице три-четыре дня, и затем в мочеиспускательном канале в течение еще нескольких недель остаётся катетер для помощи с мочеиспусканием.
Любой хирургический подход несёт в себе значительный риск возможных осложнений, таких как инфекция, кровотечение, длительная госпитализации, нарушения мочеиспускания и импотенция. В целом, открытая простатэктомия является весьма эффективным методом лечения рака простаты. При длительном наблюдении в течении 10-15 лет после операции отсутствие рецидивов наблюдается у 97% пациентов. Сложности при мочеиспускании обычно проявляются после операции, но иногда сохраняются более длительное время. Недержание мочи может возникнуть у 5-15% пациентов. Импотенция, по данным исследований, наблюдается у 40-80% пациентов.
Лапароскопическая простатэктомия
Все более распространенной хирургической процедурой становится лапароскопическая простатэктомия, поскольку является менее инвазивным вмешательством. Ее особенностью является то, что хирурги делают несколько маленьких разрезов в брюшной полости. Через эти разрезы, с помощью специальных инструментов, проводится удаление простаты и окружающих тканей. Эффективность лапароскопической простатэктомии такая же, как и при открытой операции, однако осложнений меньше.
Пациенты, как правило, госпитализируются на 1-3 дня, а катетер остаётся в мочеиспускательном канале в течение еще 7-10 дней. Большинство лапароскопических простатэктомий в западных клиниках являются роботизированными. Исследования показали, что риск развития осложнений мочеиспускания значительно меньше, чем при нероботизированной операции. Недержание мочи определяется у 1-20% больных, вероятность импотенции при этом 3-39%.
Лечение рака простаты без операции
Дистанционная лучевая терапия
Лучевая терапия является неинвазивной процедурой, во время которой для уничтожения раковых клеток в простате применяют низкие дозы радиации. Перед лечением пациенту проводится КТ и МРТ исследование для точного определения расположения предстательной железы и окружающих структур. Затем создаётся план подведения излучения к простате. В зону облучения также попадают некоторые окружающие здоровые ткани, что связано с движениями самой простаты внутри тела, например, под воздействием газа в прямой кишке или мочи в мочевом пузыре во время сеанса. Сами сеансы безболезненны и длятся по нескольку минут.
Лечение, как правило, проводится в амбулаторных условиях, пять дней в неделю, от семи до десяти недель. Дистанционная лучевая терапия (ДЛТ) может быть проведена c 3D-планированием, с использованием 5-7 компланарных лучей. Используется также лучевая терапия с модуляцией интенсивности (IMRT), когда доза модулируется в каждом из этих пучков.
Дистанционная лучевая терапия рака простаты даёт 5-летнее безрецидивное течение у 97% больных. Отсутствие рецидивов в течение 10 лет отмечается в 78-81%. Исследования показали, что в первые 3 года после лечения, примерно у 3-5% мужчин наблюдаются нарушения мочеиспускания умеренной и средней тяжести, а у 2-14% пациентов отмечаются нарушения со стороны прямой кишки. Импотенция выявляется у 35-54% пациентов.
Радиохирургия рака предстательной железы
Роботизированная радиохирургическая система КиберНож (CyberKnife) была сертифицирована в 2001 году Федеральным Агенством по контролю за продуктами и лекарствами (FDA) в США для лечения опухолей в любой части тела, в том числе рака простаты.
Лечение с помощью системы Кибернож, несмотря на своё название, не предполагает хирургического вмешательства, не требует наркоза и разреза тканей. Это один из видов стереотаксической радиотерапии (SBRT), который обеспечивает максимально точное подведение высоких доз облучения к злокачественным новообразованиям предстательной железы за ограниченное количество сеансов. Это альтернативный метод лечения рака простаты. Лечение, как правило, проводится амбулаторно, в течении 4-5 дней и не требует госпитализации. Большинство пациентов не испытывают каких-либо побочных эффектов во время и после лечения.
Брахитерапия
Брахитерапия является инвазивной процедурой, во время которой простата облучается имплантируемыми источниками радиации. Существуют два вида брахитерапии: с дозами низкой мощности (LDR) и высокой мощности (HDR).
Низкодозная брахитерапия
При низкодозной брахитерапии небольшие радиоактивные семена, размером с рисовое зерно, внедряются в простату и остаются там постоянно. Как правило, в предстательную железу посредством иглы устанавливаются от 40 до 100 радиоактивных зёрен. Для того, чтобы уменьшить дискомфорт, процедура проводится с использованием спинальной или общей анестезии. Процедура может потребовать госпитализации на ночь. Эти семена выделяют низкую дозу облучения в течении нескольких недель или месяцев, и пациент является радиоактивным всё это время. Низкодозная брахитерапия обеспечивает долгосрочный безрецидивный показатель у 83-96% пациентов. Около 8% пациентов могут испытывать умеренные или тяжелые побочные эффекты со стороны мочевыделительной системы и прямой кишки. Сексуальная дисфункция определялась у 30-45% пациентов. Качество сексуальной жизни после брахитерапии лучше, чем после операции.
Высокодозная брахитерапия
Высокодозная брахитерапия обеспечивает введение высоких доз радиации в простату в течение короткого периода времени. Как правило, процедура проводится 12-20 полыми иглами, содержащими катетеры, которые вставлены через кожу в простату. Операция обычно проводится под спинальной анестезией и часто требует госпитализации на ночь. После установки катетеров проводится КТ или МРТ исследование, для того чтобы подтвердить их точное расположение относительно простаты и окружающих тканей. После создания плана лечения, радиоактивный источник помещается через катетеры так, чтобы излучение, могло достичь простаты. Радиоактивный материал остаётся в простате от 5 до 15 минут, а затем удаляется. Обычно лечение происходит в течение нескольких дней, а катетеры удаляются после последней процедуры.
Исследования показали, что при использовании высокодозной брахитерапии отсутствие рецидивов в течении 5-8 лет определяется у 89-97% пациентов. При этом риски побочных эффектов со стороны мочевыделительной системы, прямой кишки или сексуальной функции приблизительно такие же, как и при низкодозной брахитерапии. Тем не менее, эта процедура может быть болезненной и трудной для пациентов из-за её инвазивности.
Гормональная терапия
Мужские гормоны, известные как андрогены, как правило, поддерживают рост клеток рака простаты. Целью гормональной терапии является уменьшение выделения этих специфических гормонов, для того, чтобы контролировать рост раковых клеток простаты. Гормональную терапию обычно назначают в комбинации с другими методами лечения, в том числе с дистанционной лучевой терапией, брахитерапией или перед операцией, для уменьшения размеров опухоли. Побочные эффекты, связанные с гормональной терапией, могут включать в себя снижение либидо, импотенцию, остеопороз и болезненные ощущения в груди.
Активное наблюдение
Рак предстательной железы часто характеризуется медленным темпом роста. Поэтому, вместо немедленного лечения, врачи могут рекомендовать активное наблюдение, которое включает регулярные тесты ПСА и пальцевое исследование простаты. В ряде случаев, у мужчин пожилого возраста, а также имеющих проблемы со здоровьем, развития заболевания до опасной стадии может так и не наступить.
Как выбрать метод лечения рака предстательной железы
Рак предстательной железы (РПЖ) у мужчин в структуре смертности от злокачественных новообразований составляет 7,6%, а частота заболеваемости — почти 15%. Но специалисты спорят, лечить ли этот рак, как лечить и проводить ли скрининг (тест ПСА). Почему это происходит, рассказывает Виктор Горелов, руководитель Центра брахитерапии Клинической больницы № 122 им.Л.Г.Соколова.
— Виктор Павлович, смертность от РПЖ в Петербурге остается высокой. А в медицинском мире уже не первый год продолжаются дискуссии на тему «лечить или не лечить рак предстательной железы», а также действительно ли необходим скрининг для мужчин — исследование ПСА.
— Можно сколько угодно дискутировать и неоднозначно относиться как скринингу, так и к лечению РПЖ, а в США тест ПСА существенно снизил смертность от рака простаты. Но там его проводят в масштабах всей страны и в строго определенных возрастных границах. И у нас приказом Минздрава предписано всем мужчинам от 50 до 70 лет раз в год исследовать ПСА. Только этим рекомендациям не всегда и не везде следуют, поэтому у нас около трети пациентов обращаются к врачу с уже распространенным раком, когда ждать больших успехов в лечении невозможно. И наоборот, в поликлиниках часто это исследование назначается без показаний, что чревато гипердиагностикой.
Ограничения по возрасту в рекомендациях неслучайны: РПЖ – болезнь пожилых. Как исключение из правил, у меня был пациент в возрасте 37 лет, появляются 1-2 человека в год в возрасте 42-45 лет. Но средний возраст заболевших — 68-70 лет.
Мы недавно прооперировали 42-летнего мужчину, который нашел у себя рак после теста ПСА. Зачем он его делал, непонятно — не было оснований: ни характерных жалоб, никаких проявлений болезни. Скорее всего, он узнал бы, что у него рак предстательной железы лет через 10 и за это время с ним ничего бы не случилось — это медленно развивающаяся опухоль. То есть не зря называется во всех рекомендациях нижняя планка 50 лет, если нет факторов риска. Верхняя планка ограничена 70 годами, потому что проводить скрининг людям более старшего возраста бессмысленно – если у них нет характерных жалоб, и их ничего не беспокоит, не надо каждый год сдавать ПСА и ждать появления рака: у мужчин старше 80 лет он появляется в 80% случаев, и его можно считать хроническим заболеванием. У пожилых людей он развивается так медленно, что в результате человек проживет отмерянный ему срок и умрет вовсе не от рака предстательной железы. То есть скрининг ПСА необходимо проводить разумно, не надо дискредитировать этот метод диагностики.
— Но если пациент обследовался и узнал о том, что у него рак, ему сложно отказаться от лечения — страшный диагноз есть, а его не лечат.
— Когда у пациента появляется диагноз, он попадает в этакий медицинский водоворот. И дело даже не в многочисленных обследованиях, перед ним стоит выбор — лечиться или не лечиться, а если лечиться, то как. Когда я общаюсь с пожилым пациентом, у которого выявлен рак низкого риска, то я часто предлагаю воздержаться от радикального лечения и остаться под постоянным наблюдением специалиста. То есть вопрос «лечить или не лечить» в каждом случае решается индивидуально. Хотя в отношении молодых мужчин это наблюдение не всегда выглядит рационально: впереди большая жизнь и человек хочет обезопасить себя, чтобы не оказаться через несколько лет с запущенной стадией рака. Тем более что существуют методы щадящего лечения, которые позволяют это сделать с минимумом ограничений и минимумом осложнений.
— Какой метод лечения предстательной железы можно назвать самым современным или предпочтительным в лечении этого заболевания?
— Сейчас на уровне национальных рекомендаций (российских, европейских, американских) используются три метода лечения рака предстательной железы с доказанной эффективностью: брахитерапия, радикальное хирургическое удаление предстательной железы (простатэктомия) и высокодозная дистанционная лучевая терапия. При локализованном раке низкой степени риска рецидива они абсолютно одинаковы по эффективности. Только брахитерапия наиболее щадящий метод лечения. Выбирают ее потому, что она позволяет человеку сохранять привычный ритм жизни: после того, как мы устанавливаем пациенту источники излучение, он иногда задает нам вопрос: «А вы точно что-то сделали?». Нет общего наркоза, процедура длится не более часа, нарушения целостности тканей минимальны, реабилитационный период короткий, ограничения в образе жизни есть, но сними можно смириться.
— Тогда, что такое собственно брахитерапия? С одной стороны, это облучение, то есть лучевая терапия, с другой, ее называют операцией.
— Брахитерапия — это щадящая операция, в ходе которой в орган, пораженный злокачественной опухолью вводятся источники радиоактивного излучения. В урологии — для лечения рака предстательной железы может использоваться и высокодозная брахитерапия, а мы применяем именно низкодозную, при которой источники излучения (титановые капсулы размером 8 мм, внутри которых находится изотоп йода-125) остаются в органе навсегда. Они работают в нем не более двух лет, прицельно уничтожая опухоль при минимальном повреждении здоровых тканей. С 2007 года, когда мы только начинали заниматься брахитерапией, пользовались немецкими микроисточниками компании «ECKERT&Ziegler ». Это европейский лидер по изготовлению источников излучения на основе йод-125 для брахитерапии рака предстательной железы. А с 2014 года российская компания «БЕБИГ» локализовала производство в Дубне и производит источники уже у нас на условиях полного цикла.
Специалисты нашего центра учились в Германии, там брахитерапию называют офисной операцией, а клиники брахитерапии могут располагаться в обычных офисных центрах: приходит пациент, ему выполнили имплантацию и в этот же день отпустили домой.
— Вы говорите, что брахитерапия рекомендована пациентам с минимальным риском развития рецидива? Что означает «минимальный риск»?
— Существует три группы риска развития рецидива. Они определяются следующими критериями: уровень простатического специфического антигена (ПСА), стадия опухолевого процесса, степень злокачественности опухоли. Соответственно, мы делим пациентов на группы низкого, промежуточного и высокого риска развития рецидива.
— Брахитерапия показана тем, у кого опухоль не вышла за пределы предстательной железы?
— Показана она многим, как и два других метода, но мы рассказываем пациенту обо всех и объясняем в чем их отличия, плюсы и минусы. После наших объяснений он принимает решение. Когда готовим пациента к радикальной простатектомии (хирургическому удалению предстательной железы), мы всегда предупреждаем его о возможном риске недержания мочи и возможном развитии эректильной дисфункции. После брахитерапии риск недержания мочи минимален, а нарушение эректильной функции хоть и случаются, но гораздо реже, чем после хирургического лечения. Наша статистика говорит о том, что чем моложе пациент и чем меньше у него жалоб, связанных с половой функцией, тем выше вероятность сохранить ее после брахитерапии. То есть ее качество сохраняется в зависимости от возраста и исходных показателей.
— Почему пациент с низким риском рецидива и неагрессивной опухолью не может выбирать только малотравматичную брахитерапию?
— Все зависит от индивидуальных особенностей. Например, опухоль может быть маленькой, а сама предстательная железа — большой (с возрастом у мужчины еще формируется и доброкачественная гиперплазия предстательной железы, в народе ее называют аденомой простаты). Это заболевание, при котором простата разрастается и нарушается процесс мочеиспускания. Мы отказываем в брахитерапии пациентам с выраженной ДГПЖ, большим объёмом предстательной железы и низким качеством мочеиспускания. Для таких мужчин методом выбора является радикальная простатэктомия – для них это возможность избавиться сразу от двух заболеваний.
Группа пациентов с умеренным или так называемым промежуточным риском — очень неоднородная, поэтому для них используется индивидуальный подход. В одних случаях мы выполняем брахитерапию, в других — рекомендуем другие методы лечения.
— У пациентов с запущенными опухолями, а значит, и с высоким риском развития рецидива нет шансов избежать хирургического лечения?
— Пациентам с агрессивными опухолями мы не можем предложить обычную брахитерапию. Однако в Петербурге мы первыми начали использовать так называемую сочетанную лучевую терапию. Мы сотрудничаем со специалистами Российского научного центра радиологии и хирургических технологий им. Гранова (РНЦРХТ). У них пациент на линейном ускорителе получает дистанционное облучение предстательной железы, окружающей жировой клетчатки и лимфатических узлов. А потом уже мы подводим максимально возможную дозу излучения внутрь органа, потому что дистанционно такую дозу невозможно подвести через кожу, мочевой пузырь, окружающие органы — каждый из них имеет свой предел лучевой нагрузки. В мире такой комбинированный подход признается одним из самых эффективных способов лечения рака предстательной железы высокого риска.
— Центру брахитерапии в Клинической больнице №122 исполнилось уже 10 лет. Сколько человек вы пролечили этим методом и что делаете, когда у ваших пациентов развивается рецидив?
— За эти годы мы выполнили почти 2000 операций. Но не количество определяет качество. Мы замкнули на себе весь цикл ведения пациента, от ранней диагностики заболевания и предоперационного обследования до лечения (это может быть брахитерапия, радикальная хирургическая операция, медикаментозное лечение) и последующего наблюдения. Кроме того, после лечения мы стараемся не «отпускать» наших пациентов. Собираем информацию по телефону, приглашаем на осмотр, проводим контрольные обследования. Если возникают осложнения, лечим.
Даже самые эффективные методы лечения не дают 100-процентный результат, от рецидива никто не застрахован. Нужно своевременно его диагностировать и подобрать правильное лечение. У нас есть опыт проведения повторной имплантации источников при развитии рецидива, девятнадцати пациентам мы выполнили радикальную простатэктомию. Очень хорошие результаты — при применении дистанционной лучевой терапии рецидива рака предстательной железы, как я уже говорил, мы обычно направляем пациентов в РНЦРХТ. Для некоторых достаточно только медикаментозного лечения.
— Виктор Павлович, вы впервые использовали брахитерапию для лечения рака поджелудочной железы и рака прямой кишки. Как вы считаете, сможет ли этот щадящий метод лечения использоваться в лечении злокачественных новообразований не только предстательной железы, но и этих органов?
— На основании двух операций пока сложно делать обобщения. Кроме того, нужно наблюдать пациентов, которым мы выполнили брахитерапию на поджелудочной железе и прямой кишке. Им мы точно помогли, но пока только в рамках клинических исследований. Чтобы метод вошел в практику лечения злокачественных новообразований этих органов, должно пройти немало времени.
— Сейчас в России многие коллеги-урологи работают с изобретенными вами приставками для выполнения брахитерапии под контролем компьютерной томографии. Какие еще разработки ведутся в это области?
– Патент на нашу приставку, с помощью которой делаем брахитерапию, мы получили в 2011 году. Это устройство позволяет проводить прицельную биопсию предстательной железы и высокоточную имплантацию радиоактивных микроисточников под контролем компьютерного томографа. Важно и то, что приставка, разработанная нами, производится в Петербурге, она намного дешевле и доступнее заграничных устройств для выполнения брахитерапии. В общей сложности сотрудники нашего центра получили 7 патентов РФ на изобретение, это не только оборудование, но и оригинальные методы диагностики и лечения. Например, операция по профилактике расстройств мочеиспускания у пациентов со злокачественными опухолями предстательной железы.
— Над чем вы работаете сейчас?
— Над так называемой Fusion-биопсией, основанной на совмещении изображения МРТ с КТ и позволяющей повысить точность диагностики. С помощью МРТ, как наиболее точного метода визуализации опухолевых очагов, мы можем получать гистологический материал именно из патологического очага предстательной железы. Эта методика сейчас набирает обороты, но отечественного оборудования и программного обеспечения для ее использования нет, а зарубежное очень дорогое. Вместе с коллегами из университета ИТМО мы работаем над созданием собственной программы, которая позволит выполнять биопсию под контролем компьютерной томографии и с использованием диагностических изображений МРТ. Это нам даст точность: мы сможем диагностировать клинически значимый рак и минимизировать частоту выявления латентных опухолей. А затем мы планируем начать использовать эту методику для выполнения фокальной брахитерапии, когда источники излучения будут помещаться только в патологический очаг, а не распределяться по всему органу.


