Методы приготовления и стерилизации питательных сред.
Цель занятия: Ознакомиться с различными видами питательных сред, используемых в микробиологии. Научиться готовить питательные среды по прописям. Познакомиться с методами стерилизации питательных сред.
Материалы и оборудование: химические реактивы, колбы, стеклянные воронки, плитка, фильтровальная бумага, марля, весы, прописи питательных сред, автоклав.
Задания:
- Приготовить питательные среды МПА, агар Чапека, крахмало-аммиачный агар, картофельный агар, голодную среду, среды для выделения различных групп микроорганизмов.
- Сварить и профильтровать среды, подготовить их к стерилизации в автоклаве.
- Познакомиться с методами стерилизации питательных сред.
- Простерилизовать среды в автоклаве под руководством преподавателя.
Методические указания:
Питательные среды. Известно очень много питательных сред для культивирования микроорганизмов (более двух тысяч наименований было классифицировано Левином и Шёнлейном еще в 1930 г), но число ингредиентов, являющихся их неотъемлемыми компонентами, относительно невелико. Однако качественный диапазон этих сред весьма широк – от растворов неорганических солей, на которых могут расти автотрофы, до сложных питательных сред, приготавливаемых из мясных гидролизатов, обогащенных кровью или сывороткой; ими обычно пользуются для выделения патогенных микроорганизмов типа стрептококков, отличающихся высокой требовательностью к составу питательной среды. Различают два основных типа питательных сред: так называемые синтетические среды, главные составные части которых точно известны (например, глюкозо-солевая питательная среда), и эмпирически подобранные питательные среды природного происхождения, состав которых точно неизвестен (к ним относятся пептоны, приготавливаемые из частично гидролизованного белка).
Выбор питательной среды зависит в значительной степени от цели эксперимента. Герберт настойчиво высказывался за повсеместное использование синтетических питательных сред. Однако следует признать, что они обладают рядом практических неудобств. Микроорганизмы, выращенные на таких питательных средах, обычно фенотипически отличаются от выращенных на питательных средах естественного происхождения типа бульона (например, по составу и по скорости деления). Многие бактерии нуждаются в большом числе факторов роста, и для некоторых из них до сих пор не найдены искусственные среды, на которых они могли бы размножаться. Возможно, что все эти неудобства ее временем будут преодолены, но пока среды неизвестного состава типа бульонов, приготовленных из перевара, используются весьма широко, хотя они и вносят в эксперимент неконтролируемые факторы.
В состав сред, применяемых для выращивания бактерий, входят необходимые для построения белков цитоплазмы органогены: азот, углерод, водород, кислород, неорганические соединения, содержащие фосфор, калий, серу, натрий, магний, железо, микроэлементы: кобальт, йод, марганец, бор, цинк, молибден, медь и др. Все перечисленные элементы должны находиться в питательной среде в удобоусвояемом для данного микроорганизма соединении, причем требования различных микробов в этом отношении неодинаковы. Потребность в кислороде и водороде бактерии удовлетворяют главным образом за счет поступающей в клетку воды. По характеру усвоения азота микроорганизмы делятся следующим образом: одни из них извлекают азот из простых аммонийных соединений, другие нуждаются в аминокислотах, третьи расщепляют высокомолекулярные вещества — пептоны, представляющие собой продукты неполного ферментативного переваривания белков. Строго паразитические виды бактерий размножаются только в присутствии нативного, т. е. неизмененного, белка. Источником углерода для бактерий являются главным образом различные углеводы: сахар, многоатомные спирты, органические кислоты и их соли. Потребность бактерий в неорганических элементах удовлетворяется прибавляемыми к питательной среде солями: NaCI, KH2P04, K2HP04 и т. д.
Микроэлементы, выполняющие роль катализаторов химических процессов, необходимы в ничтожно малых количествах и поступают в питательную среду с пептоном, неорганическими солями и водой. Наряду с перечисленными органическими и неорганическими элементами бактерии нуждаются в ростовых факторах, которые по своей роли соответствуют витаминам для животных. Источником факторов роста являются прибавляемые к питательной среде продукты растительного и животного происхождения, содержащие в своем составе никотиновую, пантотеновую, парабензойную кислоты, витамины. Питательные вещества могут усваиваться микробами только при определенной реакции питательной среды, так как проницаемость оболочек микробных клеток изменяется в зависимости от рН среды. Потребность в питательных веществах и физических условиях у различных видов микробов неодинакова и этим исключается возможность создания универсальной питательной среды.
По консистенции различают плотные и жидкие питательные среды. Плотные питательные среды готовят из; жидких питательных сред посредством прибавления к ним клеевых веществ агара или желатина. Агар-агар (по-малайски желе) – продукт растительного происхождения, добываемый из морских водорослей. В воде агар-агар растворяется при температуре 80-86° С, застудневает при 36-40° С. Применение агаровых сред благодаря их способности сохранять плотность при температуре 37°С дало возможность выращивать микробов при оптимальной для большинства из них температуре на плотных средах. Желатин – вещество белковой природы животного происхождения. В теплой воде при температуре 32-34°С он набухает и растворяется, а при более низкой температуре превращается в студень. Однако при рН ниже 6,3 и выше 7,0 плотность желатина уменьшается, и он плохо застывает.
Требования, предъявляемые к питательным средам.
Питательные среды должны:
1. Содержать необходимые для питания микроба питательные вещества.
2. Иметь реакцию рН, оптимальную для выращиваемого вида микроба.
3. Иметь достаточную влажность, так как микробы питаются по законам диффузии и осмоса.
4. Обладать изотоничностью.
5. Быть стерильными, обеспечивая тем самым возможность выращивания чистых культур микробов.
Питательные среды подразделяются на среды общего назначения и специальные.
К первой группе относятся мясо-пептонные: агар, бульон, питательный желатин. Среды общего назначения используют для выращивания многих микробов и применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроба.
К специальным питательным средам относятся элективные (избирательные) и дифференциально-диагностические.
Элективные (избирательные) среды. Принцип создания элективных питательных сред основан на удовлетворении основных биохимических и энергетических потребностей того вида микроба, для культивирования которого они предназначены. Определенный состав и концентрация питательных микроэлементов, ростовых факторов при строгом значении рН обеспечивают оптимальные условия для выращивания одного или нескольких видов микроорганизмов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной.
Дифференциально-диагностические среды. Эти питательные среды используют для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. По своему назначению дифференциально-диагностические питательные среды подразделяются следующим образом:
1. Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин и т. п.
2. Среды с индифферентными химическими веществами, которые служат источником питания для одних видов микробов и не усваиваются другими видами.
3. Среды с углеводами и многоатомными спиртами для обнаружения соответствующих ферментов.
4. Среды для определения редуцирующей способности микробов.
В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических и окислительно-восстановительных ферментов, вводят индикаторы: нейтральную красную, метиленовый синий, лакмусовую настойку, кислый фуксин, бромтимоловый синий, водный голубой краситель и розоловую кислоту. Изменяя свою окраску при различных значениях рН, индикатор указывает на наличие или отсутствие расщепления, окисления или восстановления введенного в среду ингредиента. Однако индикатор не является обязательной составной частью сред, предназначенных для выявления ферментов. Так, наличие желатиназы и других протеолитических ферментов в культуре определяют по разжижению желатина, свернутого яичного или сывороточного белка.
Сухие питательные среды. Приготовление питательных сред – один из наиболее ответственных участков работы бактериологической лаборатории. В связи с этим биопромышленность выпускает стандартные, консервированные, сухие питательные среды, различного назначения, для культивирования микроорганизмов. Готовят среды по прописи, указанной на этикетке. Постоянство состава, стандартность среды, простота и удобство в работе, легкость транспортировки и хранения являются большим преимуществом сухих питательных сред. После установления соответствующего рН среду кипятят, фильтруют, осветляют, разливают во флаконы, пробирки и стерилизуют. Следует учитывать, что после стерилизации среда становится более кислой.
Стерилизация питательных сред. Стерилизацию питательных сред осуществляют различными способами в зависимости от тех ингредиентов, которые входят в их состав.
1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15-20 мин в автоклаве при температуре 115-120°С.
2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112° С.
3. Среды, в состав которых входят белковые вещества (сыворотка крови), обеспложиваются тиндализацией или фильтрованием.
4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца.
Подготовленные питательные среды проверяют на стерильность. Для этого их ставят в термостат при температуре 37°С. Среды, простерилизованные в автоклаве, выдерживают в термостате 1 сут, простерилизованные текучим паром – 3 сут.
Дата добавления: 2018-10-26 ; просмотров: 1285 ; Мы поможем в написании вашей работы!
Классификация питательных сред
При приготовлении питательных сред необходимо учитывать потребность культивируемых микроорганизмов в различных элементах питания. Существует различные классификации питательных сред.
Классификация питательных сред по составу:
1. Простые среды (МПБ, МПА, желатин, пептонная вода). Мясо-пептонный бульон (МПБ) является белковой основой всех сред.
Существует несколько способов приготовления МПБ:
а) на мясной воде с добавлением готового пептона;
б) на переварах продуктов гидролиза исходного сырья при помощи ферментов.
Мясо-пептонный агар (МПА) — получают путем добавления агар-агара (1,5-3%) к МПБ. Если МПА распределен по диагонали пробирки или флакона — это скошенный агар. Если среда распределена в пробирке вертикально высотой 5-7 см, это агар столбиком. МПА, застывший в чашках Петри в виде штастшки — пластинчатый агар. Если среда имеет вертикальный слой высотой 2-3 см, и диагональный слой такой же величины, это полускошенный агар.
2. Сложные среды готовятся на основе простых с определенными добавками (углеводы, кровь, желчь, яйца, сыворотка, молоко, соли, факторы роста и т.п.)
Классификация питательных сред по исходным компонентам:
1. Естественные питательные среды — это натуральный продукт животного или растительного происхождения.
Могут быть:
– Растительные (исходные продукты — соя, горох, картофель, морковь и т.п.).
– Животные (исходные продукты — мясо, рыба, яйца, молоко, животные ткани, желчь, сыворотка крови и т.п.).
– Смешанные (МПА, среда Левенштейна – Йенсена и т.п.).
2. Искусственные среды содержат переработанные естественные продукты (мясную воду, перевар), вещества, полученные из этих продуктов (пептон, дрожжевой и кукурузный экстракты) и различные добавки. Это самая большая и разнообразная по составу наиболее часто применяемая группа сред. Их готовят по определенным рецептам из различных настоев или отваров животного или растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ.
3. Синтетические среды (известного химического состава) состоят из химически чистых соединений в точно установленных концентрациях (с добавлением углеводов, солей, аминокислот, витаминов и т.п.). На основе этих сред, добавляя к ним естественные или искусственные среды, получают полусинтетические среды.
Классификация питательных сред по консистенции: среды бывают жидкие (среды без агара), полужидкие (с агаром до 1%), плотные (агаровые — 1,5-2,5%). Жидкие среды чаще применяют для изучения физиолого-биохимических особенностей микроорганизмов, для накопления биомассы и продуктов обмена. Полужидкие среды обычно используют для хранения культур, плотные — для выделения микроорганизмов, изучения морфологии колоний, диагностических целей, количественного учета, определения антагонистических свойств и др.
Классификация питательных сред по целевому назначению: универсальные (общеупотребительные) и специальные.
Универсальные (основные) среды. Эти среды используют для культивирования большинства относительно неприхотливых микроорганизмов или применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроорганизмов. К этой группе относятся: МПБ — мясо-пептонный бульон, МПА — мясо-пептонный агар, МПЖ — мясо-пептонный желатин и т.п.
Специальные среды. Предназначены для выделения и избирательного культивирования определенных видов микроорганизмов, которые не растут на простых средах.
Различают следующие виды специальных сред: среды обогащения, элективные, дифференциально-диагностические, консервирующие и среды накопления.
Среды обогащения. Многие микроорганизмы не растут на обычных средах, поэтому для повышения питательной ценности среды в нее добавляют углеводы (сахарный бульон или агар) или белки (сывороточный агар и бульон, кровяной агар и бульон). Кровяной агар или кровяной бульон — получают путем добавления к питательной среде 5-10% подогретой стерильной дефибринированной крови барана, кролика, лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности. Сывороточный бульон или сывороточный агар получают, путем добавления к простым средам 15-20% лошадиной или бычьей сыворотки.
2. Элективные (избирательные) среды. Эти среды предназначены для избирательного выделения и накопления микроорганизмов определенного вида из материала, содержащего несколько видов микробов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной. Избирательность среды достигается путем создания условий, оптимальных для культивирования определенных микробов (рН, Еh, концентрация солей, состав питательных веществ), т.е. положительной селекцией. Или путем добавления в среду веществ, угнетающих другие микроорганизмы (желчь, высокие концентрации NаС1, антибиотики и др.), т.е. отрицательной селекцией. К этой группе относятся:
Селенитовая среда — является лучшей средой обогащения для сальмонелл и дизентерийных микробов Зонне. Селенит натрия, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Висмут-сульфит агар — содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний черного цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) — среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Желчный бульон элективен для сальмонелл, размножение которых стимулирует добавленная 10% желчь, одновременно тормозящая рост сопутствующих микроорганизмов.
Щелочной агар или щелочная пептонная вода элективны для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов. 3-5 сут. Ж
3. Дифференциально-диагностические среды. Дифференциально-диагностические среды применяют для дифференцировки одного вида микроорганизмов от другого по характеру их ферментативной активности. Состав этих сред подбирают с таким расчетом, чтобы четко выявить наиболее характерные свойства определенного вида микроорганизмов, основываясь на особенностях его обмена веществ.
– Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин и т.п. Наиболее распространенными средами являются мясо-пептонный желатин (МПЖ) свернувшаясялошадиная сыворотка, молоко и кровяной агар (КА).
– Среды для изучения гликолитических свойств включают три основных компонента: питательная основа (бульон, агар), субстрат (моно- и дисахара, многоатомные спирты) и индикатор для выявления соответствующих ферментов. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды. Наиболее распространены цветные среды с различными углеводами (например, с бромтимоловым синим, индикатором ВР). Также широко распространены среды Гисса, на которых учитывают различия в способности ферментировать различные углеводы с образованием кислоты, либо кислоты и газа.
Для дифференцировки энтеробактерий применяют пептонную воду с набором различных углеводов, индикатором Андреде и поплавками, облегчающими обнаружение газообразования и помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андреде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании индикатор Андреде и бромтимоловый синий не меняют цвет среды. Например, для выделения патогенных бактерий из кишечника применяют среды, которые позволяют дифференцировать патогенные микроорганизмы от постоянных обитателей кишечника — микроорганизмов, разлагающих лактозу.
Такой средой является среда Эндо. Основными компонентами среды Эндо являются МПА, лактоза и основной фуксин, обесцвеченный сульфитом натрия. Исходная питательная среда окрашена в светло-розовый цвет. При сбраживании лактозы образуется ацетальдегид, который реагирует с сульфитом и, высвободившийся при этом, фуксин окрашивает колонии в ярко-красный цвет. Поэтому кишечная палочка, которая сбраживает лактозу, при росте на этой среде образует красные колонии с металлическим блеском, а сальмонеллы и шигеллы — бесцветные, так как они не сбраживают лактозу.
4. Среды накопления, на которых происходит быстрый рост определенных видов микроорганизмов.
5. Консервирующие (транспортные) среды. Предназначены для сохранения микроорганизмов во время транспортировки к месту исследования. Эти среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Наибольшее применение нашли глицериновая смесь (среда Тига), фосфатно-буферная смесь и среды Кари-Блэйра, Амиеса (с активированным углем и без активированного угля), Стюарта и др.
Стерилизация питательных сред.
Все питательные среды независимо от их назначения разливают в чистую посуду и стерилизуют. Большинство сред стерилизуют автоклавированием, но при различных режимах в зависимости от их состава.
1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15-20 мин в автоклаве при температуре 115-120°С и давлении 1-1,5 атмосферы.
2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112°С и при давлении до 1 атмосферы.
3. Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием.
4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца.
Для контроля стерильности среды после стерилизации помещают в термостат при 37°С на 3-5 сут. Жидкие среды должны оставаться прозрачными, а на поверхности и в толще плотных питательных сред не должны появляться признаки роста. Кроме контроля стерильности, про-изводят химический контроль готовых сред, который заключается в том, что в нескольких об-разцах каждой серии определяют рН, количество общего и аминного азота и хлоридов.
Существует также биологический контроль сред. В этом случае несколько образцов среды засевают лабораторной культурой того микроба, для которого приготовлена среда, и изучают характер его роста. Только после того, как среды выдержали контроль, их можно использовать по назначению.
Тема: питание бактерий. простые питательные среды. посев на мпа и мпб. методы стерилизации

Под питательными средами
подразумевают различного рода субстраты, приготовляемые для изучения
жизнедеятельности микроорганизмов при определенных условиях, изменяемых по воле
экспериментатора. Микрохимические анализы и опыты искусственной культуры
выяснили потребность бактерий в питательных веществах. Согласно этим указаниям
и составляются питательные среды. Существенным условием при этом является
определенное содержание воды. Сухие органические вещества
не заселяются микробами; соление консервирует мясо, отнимая у него известное
количество воды. Первенствующее значение для жизнедеятельности микроорганизмов
имеет затем реакция питательной среды; для большинства бактерий
она должна быть нейтральной или слабощелочной, рост
холерного вибриона прекращается уже при слабокислой реакции. Вас. erythosporus
и micrococcus aquatilis размножаются даже в дистиллированной, 2 раза
перегнанной воде, удовлетворяясь, очевидно, тем ничтожным количеством
органических веществ, какое содержится и в чистой перегнанной воде, или, быть
может, питаясь за счет азота и углерода атмосферного воздуха. Некоторые
микроорганизмы заимствуют нужный им для питания азот из аммиачных или
азотнокислых соединений, другие безусловно требуют наличности в питательной
среде белковых веществ.
Большинство болезнетворных
микроорганизмов хорошо растут в бульоне, мясопептонной желатине и на агаре; другие,
наоборот, нуждаются в питательной среде (кровяной сыворотке, агаре, смазанном
кровью, и т.п.), по составу своему приближающейся к составу тканей и соков
животного организма.
Некоторые строго паразитные
бактерии совершенно не выращиваются на мертвом субстрате, размножаясь лишь в
организме живого существа и даже иногда определенного животного. До сих пор не
удается культивировать на какой-либо искусственной питательной среде лепрозную
палочку, некоторые слюнные бактерии, спирохету возвратной горячки и др.
ПИТАТЕЛЬНЫЕ СРЕДЫ
Выращивание (культивирование) микроорганизмов используется в лабораторных и производственных условиях для выделения, накопления и сохранения микроорганизмов.
Для культивирования микроорганизмов используют специальные питательные среды, которые должны содержать необходимые питательные вещества и являться оптимальной средой обитания микроорганизмов.
В состав питательной среды обязательно входят 5 основных элементов ( С, Н2, О2, N) и зольные элементы, микроэлементы, количество воды не менее 60%.
Универсальных сред, пригодных в равной степени для всех микроорганизмов, не существует. В закономерности от особенностей обменных процессов (фотосинтез, способы получения энергии) отдельным видам микроорганизмам требуются различные составы питательных веществ.
По составу питательные среды подразделяются на 2 группы:
Естественными
называются среды, которые состоят из натуральных пищевых продуктов (молоко, яйца, мясо). Большинство из них применяют в виде экстратов или настоев. Эти среды имеют сложный, непостоянный химический состав и мало пригодны для изучения физиологии обмена веществ микроорганизмов. Они используются главным образом для поддержания культур микроорганизмов, накопления их биомассы и диагностических целей.
Примерами служат мясопептонный бульон, почвенная вытяжка, картофельная среда.
Искусственные среды (синтетические среды) — это среды, в состав которых входят только определенные, химически чистые соединения, взятые в точно указанных концентрациях. Синтетические среды удобны для использования обмена веществ микроорганизмов. Зная точный состав и количество входящих в среду компонентов, можно изучить их потребление и превращение.
Для разработки синтетических сред необходимо знать потребности микроорганизмов в источниках питания и основные особенности их обмена веществ.
В большинстве случаев синтетические среды готовят на водопроводной воде и микроэлементы не добавляют.
К ним можно отнести: гидролизат козеина, дрожжевой автолизат, кукурузный экстракт.
По назначению различают элективные и дифференциально-диагностические среды.
Элективные среды обеспечивают развитие одного вида или группы микроорганизмов и непригодны для развития других. Элективные среды применяют главным образом для выделения микроорганизмов из мест их естественного местообитания или для получения накопительных культур.
Дифференциально-диагностические (индикаторные) среды позволяют достаточно быстро отличить одни виды микроорганизмов от других. Состав этих сред подбирают с таким расчетом, чтобы позволить четко выявить наиболее характерные свойства определенного вида.
Индикаторные среды применяются в клинической бактериологии, при генетических исследованиях.
По физическому состоянию различают: жидкие, плотные, сыпучие среды.
Жидкие среды
широко применяют для выяснения физиолого-биохимических особенностей микроорганизмов, для накопления биомассы.
Плотные среды используют для выделения чистых культур (получение изолированных колоний) для хранения культур, количественного учета микроорганизмов.
Сыпучие среды
применяют в промышленной микробиологии. К ним относятся: отруби, кварцевый песок, разваренное пшено.
Для уплотнения сред применяют агар-агар, желатину и кремнекислый гель.
Агар-агар — сложный полисахарид, получаемый из морских водорослей. Агар-агар удобен тем, что большинство микроорганизмов не использует его в качестве питательного субстрата. в воде агар-агар образует гели которые плавятся при 1000С, а затвердевает при 400С. Поэтому на агаризованных средах можно культивировать микроорганизмы при любой подходящей для их роста температуре.
Информация о статье
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 18 человек(а).
Категории: Образование и коммуникации
На других языках:
English: Grow Bacteria in a Petri Dish, Español: cultivar bacterias en una placa de Petri, Italiano: Coltivare Batteri su un Piatto di Petri, 中文: 在培养皿中养细菌, Français: faire croître des bactéries dans une boîte de Petri, Deutsch: Bakterien in einer Petrischale züchten, Português: Cultivar Bactéria em uma Placa de Petri, Bahasa Indonesia: Menumbuhkan Bakteri Dalam Cawan Petri, العربية: تربية البكتيريا في طبق بتري, Nederlands: Bacteriën kweken in een petrischaal
Эту страницу просматривали 103 715 раз.
Была ли эта статья полезной?
Типы питательных сред
Питательные среды бывают жидкие
и твердые
Главное преимущество жидких сред
заключается в возможно равномерном распределении в них зародышей; этим дается
возможность всегда работать с точно отмеренным количеством бактерий, что
особенно важно при опытах с впрыскиванием последних животным для изучения силы
болезнетворного действия микрофитов. Разводка микроорганизма в жидкой среде,
введенная в полое предметное стекло, дает нам возможность изучить
непосредственно под микроскопом рост и деление клеток, образование микрофитом
различных сочетаний, появление в нем спор и их прорастание
Бульонные культуры
патогенных бактерий, освобожденные соответственной фильтрацией от живых
зародышей, представляют чистые растворы продуктов вещественного обмена
микроорганизмов, различного рода бактерийные яды (токсины), знакомство с
которыми имеет первенствующее значение для уразумения сущности заразных
болезней. Разводки в молоке, пептонной воде и др. дают нам ценные указания для
биологической характеристики многих микроорганизмов, для отличия их друг от
друга. Жидкими средами можно пользоваться, однако, лишь тогда, когда в
распоряжении имеется уже чистая разводка того или другого микроорганизма; разъединение
же зародышей, вылавливание одного из них из той смеси различнейших видов
бактерий, которая встречается в окружающей нас природе, возможно лишь при
помощи плотного субстрата, консистенция которого препятствует смешиванию между
собой различных микроорганизмов, растущих здесь совершенно особняком и на
надлежащем друг от друга расстоянии. Неожиданно быстрое развитие, достигнутое
бактериологией в последние 10 — 15 лет, главным образом обязано введению Р. Кохом
в бактериологическую технику твердых прозрачных субстратов. Питательные среды
до посева исследуемого микроорганизма должны быть тщательно обеспложены, с
целью устранения случайно поселившихся в них посторонних бактерий.
Подготовка питательной среды
Основу питательных сред для культивирования микроорганизмов составляют источники органического углерода (субстраты) . Разнообразие таких источников очень велико, так как микроорганизмы потребляют широкий спектр органических соединений, начиная от простейших углеродных соединений, таких как метан (СН4), метанол (СНзОН) и углекислота (CCh), и кончая природными биополимерами.
Кроме углерода клетки микроорганизмов в процессе роста нуждаются в источниках азота, фосфора, макро — и микроэлементов (калии, магнии. цинке, железе, меди, молибдене, марганце и др). Как правило, эти компоненты заранее вносятся в питательные среды в виде минеральных солей перед началом ферментации. Исключение составляют газообразные компоненты.
Отделение приготовления питательной среды представляет собой цех, оборудованный емкостями для хранения жидких и твердых веществ, средствами их транспортировки и аппаратами с перемешивающими устройствами для приготовления растворов, суспензий и эмульсий. При этом все компоненты питательной среды хранятся обычно в твердом виде, а приготовление их смеси в заданном соотношении производится в аппарате с мешалкой, куда они непосредственно поступают для последующего растворения. Иногда сначала в отдельных емкостях готовятся растворы каждого компонента, а потом производится их окончательное смешение.
Важнейшим элементом подготовки питательных сред является их стерилизация, поскольку выращивание промышленного микроорганизма должно проводиться, по крайней мере, в начальной стадии, в отсутствие посторонней микрофлоры. Это достигается путем предварительной стерилизации всех потоков, поступающих на стадию ферментации.
Для стерилизации газовых потоков используют фильтрацию через специальные волокнистые фильтры с определенным диаметром пор, которые задерживают клетки микроорганизмов из окружающей среды.
Все потоки могут стерилизоваться термическим, радиационным, фильтрационным или химическим методами.
Наиболее часто в промышленности используется термический метод. Он основан на губительном действии на живые клетки высоких температур. Основным недостатком термической стерилизации являются неизбежные потери питательных свойств среды. Наиболее часто в качестве источника углерода используются углеводы, которые не выдерживают нагревания до высоких температур (120-150°С). Поэтому обычно источники углерода стерилизуют отдельно от растворов минеральных солей, обладающих большей термической устойчивостью.
Некоторые субстраты сами обладают способностью подавлять рост посторонних микроорганизмов, поэтому их стерилизации не требуется. К ним относятся, например, метанол, этанол, уксусная кислота и их концентрированные растворы.
Остальные методы стерилизации применяются реже. Радиационный метод, основанный на облучении материалов большими дозами ионизирующих излучений (гамма-излучение), дает хорошие результаты. Однако он предполагает наличие мощных источников гамма-излучения. Поэтому радиационный метод используют для стерилизации небольших объектов, главным образом медицинского назначения (например, хирургический инструмент, перевязочный материал).
Химический метод
стерилизации основан на использовании веществ, обладающих дезинфицирующим действием. Основной проблемой в этом случае является необходимость удаления стерилизующего агента из питательной среды после подавления посторонней микрофлоры. Это может быть достигнуто путем его химического разложения с образованием нетоксичных для производственной культуры продуктов. К сожалению, число таких веществ очень невелико.
Фильтрационный метод
основан на пропускании питательной среды через специальные фильтры или мембраны, способные задерживать клетки микроорганизмов. Он наиболее пригоден для стерилизации питательных сред, которые не выдерживают действия высоких температур (молоко, растворы белков и др.). Основная трудность, возникающая при использовании этого метода, — необходимость стерилизации самого фильтрующего элемента, который не отличается достаточной термостойкостью.
Непрозрачные питательные среды
Из непрозрачных
питательных сред первое место занимает картофель. Он служит
прекрасным субстратом для многих сапрофитов и патогенных бактерий,
обнаруживающих на нем характерный типический рост; им пользуются также для сохранения
разводок на продолжительный срок и для обнаружения микроорганизмом
спорообразования. Крупные, так называемые салатные картофелины очищаются под
струей воды от грязи, после чего кончиком картофельного ножа вырезают все
подозрительные места (глазки), разрезают картофель на круглые пластинки, кладут
их в маленькие двойные чашки и обеспложивают в коховском аппарате. Рациональнее
еще пользоваться для разводок на картофеле широкими, в 2,5 см в диаметре,
пробирками. Пробочным сверлом вырезают из крупного картофеля цилиндр, разрезают
его по диагонали на два клина и вкладывают каждый из них в пробирку широким
концом вниз. Для предохранения разводки от загрязнения конденсационной водой,
выделяющейся из картофеля, практично пользоваться пробирками, имеющими недалеко
от дна кольцеобразное сужение, на котором и покоится картофельный клин, вода же
собирается на дно пробирки, ниже сужения. Перед опусканием картофеля в пробирку
наливают в последнюю несколько капель воды для предохранения субстрата от
высыхания.
Для пигментных бактерий
пользуются, по Сойка и Кралю, питательной средой, приготовленной из разваренного
в молоке риса: 100 г рисовой муки, тщательно растертой в ступке с 250
куб. см снятого молока, разваривают при постоянном помешивании в густую кашу и
туго набивают последней цилиндрическую трубку. По охлаждении выдавливают
рисовый цилиндр из трубки, разрезают его на несколько параллельных дисков,
укладывают каждый из них в отдельную чашку, куда наливают еще несколько капель
молока, и обеспложивают в течение 1/2 часа в коховском
аппарате. На ярком фоне этой среды разноцветные пигментные бактерии выступают
очень резко.
Хлебная мезга,
обладая кислой реакцией, служит хорошей средой для плесневых грибов. Насыпают в
эрленмейеровские колбы обыкновенный черный хлеб, высушенный и растертый в
мелкий порошок, прибавляют воды до получения однообразной влажной каши и
обезвоживают в паровом котле.
Обращение с бактериальными культурами и методы посева на питательные среды
3) при выделении чистой культуры микробов в целях всестороннего изучения их свойств и определения видовой принадлежности и т.д.
Основным методом бактериологического исследования является посев анализируемого материала на питательные среды.
Посевом в микробиологической практике называется внесение в стерильную питательную среду какого-либо исследуемого материала для обнаружения в нем микроорганизмов.
Пересев – это перенос выращенных микроорганизмов в свежую стерильную питательную среду. При выполнении этих приемов требуется перенести тот или иной материал в питательную среду так, чтобы в нее из воздуха не попали посторонние микроорганизмы.
При посевах и пересевах с одной питательной среды на другую пользуются платиновой проволокой в виде петли или иглы, так как они допускают быструю стерилизацию на огне без повреждения металла. Платиновая проволочка накаливается очень быстро и так же быстро остывает. Над пламенем горелки иглу или петлю следует держать вертикально, чтобы проволока на всем протяжении была одновременно накалена докрасна. Затем слегка обжигают прилегающий к проволоке отрезок стеклянной или металлической палочки, в которую впаяна или заделана проволочка. Нужно строго следить за тем, чтобы до внесения в огонь стеклянная палочка была совершенно сухая, в противном случае стекло треснет и петля (или игла) из него выпадет. После нагревания до красного каления платиновая проволочка будет простерилизована. Лишь после такой стерилизации петлю или иглу можно вносить в пробирку с бактериальной культурой. Но прежде чем захватить ею бактериальную культуру, петелькой или концом иглы касаются части среды, свободной от микробного налета (если имеют дело с твердой средой), или внутренней стенки пробирки с жидкой средой. Это делается для того, чтобы удостовериться, что прокаленная петля достаточно остыла. Если проволочка имеет еще высокую температуру, то среда на данном участке расплавляется или кипит. Этим создается гарантия, что бактерии, снятые проволочкой, будут вполне жизнеспособны.
Посев на жидкую питательную среду (бульон)
Посев на жидкую питательную среду производится с помощью петли и стерильных трубок и пипеток.
Посев петлей (иглой). Прокаленной петлей или иглой, которую держат в руке между указательным, средним и большим пальцами (подобно карандашу или ручке), захватывают небольшое количество налета с поверхности сырья или каплю посевного материала из исследуемой жидкости, слегка погрузив в нее петлю. В левой руке держат пробирку (или колбочку) с питательной средой. На пламени горелки обжигают верхнюю часть пробирки (колбы) непосредственно у пробки. При этом сосуд со средой слегка наклоняют, но так, чтобы жидкость не выливалась и не смачивала пробки и краев посуды. Мизинцем и безымянным пальцем правой руки вынимают пробку из пробирки и зажимают ее до конца посева между этими пальцами и ладонью так, чтобы входящая в пробирку часть пробки не прикасалась к руке. Все манипуляции производят над пламенем горелки. В открытую и наклоненную пробирку вводят петлю с посевным материалом, слегка погружая петельку в среду и размазывая внесенный материал по стенке пробирки, осторожно размешивают петлей питательную среду. Закончив посев, не изменяя наклонного положения пробирки, закрывают ее ватной пробкой, обжигая в пламени горелки конец пробирки и ту часть ватной пробки, которая входит в пробирку. Лишь после этого возвращают пробирку в вертикальное положение. По окончании посева петлю немедленно стерилизуют в пламени горелки.
Техника посева петлей бактериологического материала из одной пробирки в другую почти аналогична. Обе пробирки – с культурой и стерильной питательной средой – держат в наклонном положении между большим и остальными пальцами левой руки (рис. 56, положение а). При этом пробирку с культурой микробов следует держать ближе к себе. Вся работа, как и в первом случае, выполняется под защитой пламени горелки, а наклонное положение пробирок предохраняет питательную среду от оседания в нее микроорганизмов из воздуха.
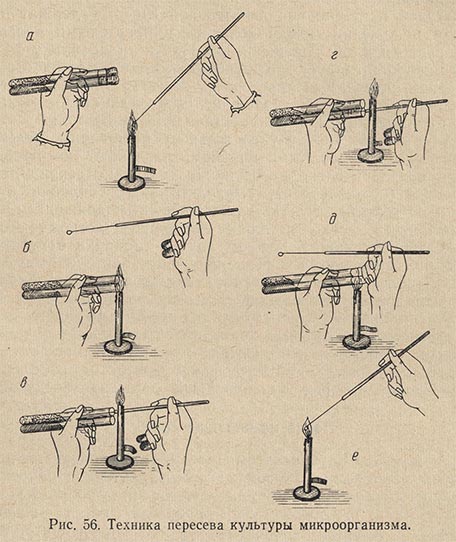
Петлю держат между указательным и большим пальцами правой руки, а свободными пальцами извлекают из пробирок пробки, предварительно внеся их на несколько секунд в пламя горелки (положение б). Извлекать ватные пробки нужно плавно, не рывком, а легким винтообразным движением.
Прокалив на огне петлю и подвергнув легкому обжигу верхние концы пробирок, вводят внутрь пробирки с культурой петлю, забирают петлей ничтожную часть бактериального материала (положение в) и переносят его во вторую пробирку со стерильной средой (положение г). Когда посев закончен, края пробирок и нижние концы ватных пробок проводят сквозь пламя горелки и легким движением закрывают пробирки пробками (положение д). Петля стерилизуется и откладывается (положение е). Работать нужно быстро, но избегая резких движений, вызывающих усиленное движение воздуха.
Посев на плотную среду
Если необходимо произвести посев на твердую питательную среду, например на «косой агар», то материал наносят на поверхность среды при помощи легких зигзагообразных движений петли. В том случае, если производят посев анаэробов, делают укол иглой, зараженной микробами, в центральную часть среды, застывшей в виде столбика (рис. 57). Пробирку при этом держат в опрокинутом вверх дном положении или под углом, чтобы уменьшить опасность загрязнения среды из воздуха. Посев нужно делать именно уколом, а не разрывать поверхность среды и не касаться ее рукояткой иглы.
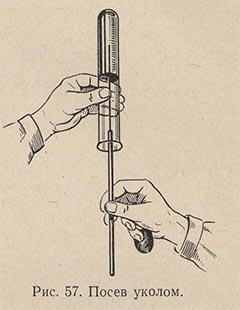
Посев уколом делают в желатиновые среды с целью выявления протеолитической способности микробов. Засеянные пробирки выдерживают 2-3 дня при температуре 22-23 °С, наблюдая за быстротой и формой разжижения столбика желатиновой среды. У различных видов микробов форма разжижения желатины различна: послойная, в форме гвоздя, чулка и пр. Затем пробирки опускают в холодную воду. Если среда в пробирке с микроорганизмом остается жидкой, а среда в контрольной пробирке застынет, это значит, что микроб обладает протеолитической способностью.
Можно установить протеолитическую способность микроба, фиксируя также образующиеся при распаде белка продукты – сероводород, аммиак, индол, являющиеся показателями протекающего процесса гниения. Наличие этих продуктов определяют с помощью цветных реакций. Сероводород дает почернение полоски фильтровальной бумаги, смоченной раствором основного уксуснокислого свинца, благодаря превращению H2S в PbS. Появление серебристой побежалости (оттенка) свидетельствует об образовании при гниении тиоспиртов и меркаптанов.
Раствор основного уксуснокислого свинца готовят приливанием к 10%-ной взвеси РЬ(СН3СОО)2 10%-ного раствора едкого натра до растворения осадка. Полоски фильтровальной бумаги пропитывают этим раствором, высушивают при комнатной температуре и хранят в склянке с притертой пробкой. При проведении опыта подготовленную полоску фильтровальной бумаги смачивают стерильной дистиллированной водой и помещают в пробирку с изучаемой культурой между ватной пробкой и стенками пробирки. Полоска бумаги должна свободно свешиваться внутрь пробирки, а не касаться ни ее стенок, ни среды. Пробку сверху плотно закрывают целлофановым колпачком (можно надеть резиновую соску), что предотвращает улетучивание выделяющихся при гниении газов.
Для выявления в продуктах гниения аммиака в пробирку с культурой микроорганизма аналогично помещают влажную красную лакмусовую бумажку, синеющую от присутствия NH3.
Индолообразование выявляется добавлением к 5 мл бульонной культуры микроба 5 мл специфического раствора Эрлиха и 2,5 мл насыщенного раствора пиросульфита калия (K2S2O7). При наличии индола появляется интенсивное красное окрашивание. Реактив Эрлиха приготовляют растворяя 4 г парадиметиламидобензальдегида в 30 мл 96%-ного спирта-ректификата, приливая затем сюда же 80 мл концентрированной соляной кислоты.
Посев уколом в высокий столбик сахарного агара дает возможность выявить у микроорганизмов степень анаэробности. Аэробы растут только в верхней части укола; анаэробы, наоборот, – только в нижней; факультативные анаэробы – по всему уколу. Укол должен проходить по возможности посредине столбика среды в пробирке на равном расстоянии от краев и доходить почти до дна. Внесение материала в толщу питательной среды можно также производить после предварительного ее расплавления и вносить материал в остуженную до 45 °С, но еще жидкую среду, а затем дать ей остыть.
Техника посева в чашки Петри
Питательный агар в колбах, флаконах, пробирках расплавляют в кипящей водяной бане. Сосуд со средой следует погружать в баню так, чтобы уровни среды и воды совпадали или уровень среды был чуть ниже уровня воды в бане. Затем среде дают несколько остыть – до 50-60 °С и разливают ее в стерильные чашки Петри, установив их на горизонтальной поверхности. Техника розлива среды в чашки Петри следующая (рис. 58). Над пламенем горелки, слегка наклоняя сосуд, содержащий расплавленный агар, вынимают пробку и края сосуда обжигают. Левой рукой приподнимают с одной стороны крышку чашки и, вводя в образовавшийся просвет открытый конец сосуда со средой, выливают среду в чашку. Совсем открывать чашку Петри нельзя. Ее лишь слегка приоткрывают с одной стороны. Это предохраняет среду от оседания в нее микробов из воздуха.
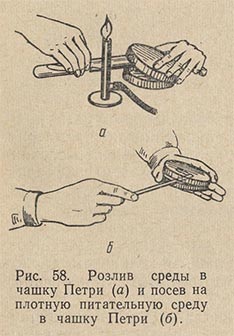
Опустив крышку и наклоняя чашку в разные стороны, распределяют налитый в нее агар ровным слоем по всему дну. Когда агар застынет, чашки ставят в термостат вверх дном для подсушивания и удаления конденсационной воды. Посев на агаровые среды в чашки Петри производится штрихом при помощи платиновой петли или стеклянным шпателем.
При посеве штрихом платиновой петлей забирают небольшое количество материала и легко проводят по поверхности агара, нанося ряд линий. При этом один край крышки чашки Петри следует лишь осторожно приподнять левой рукой, не дотрагиваясь пальцами до нижнего ранта. Закрыв первую чашку Петри той же петлей, не набирая материала, наносят штрихи на поверхность агара во второй, затем в третьей чашке с соблюдением тех же предосторожностей, предупреждающих попадание микробов из воздуха на поверхность среды.
После посева чашки ставят в термостат вверх дном на 24 ч и по истечении указанного срока рассматривают выросшие колонии микроорганизмов. В первой чашке, куда попало много материала, может получиться сплошной рост, во второй и третьей чашках вырастут единичные изолированные колонии. Каждая колония представляет собой обособленное скопление однородных микробов.
При посеве на твердую среду можно пользоваться и одной чашкой Петри, разделив ее на несколько секторов. Для этого на стекле с нижней стороны дна чашки наносят линии карандашом для стекла. Каждый отдельный сектор в данном случае будет заменять соответствующую чашку Петри.
При посеве шпателем на поверхность агаровой среды наносят платиновой петлей одну небольшую каплю исследуемого материала. Затем прокаленным и остуженным шпателем растирают эту каплю по всей поверхности среды, совершая легкие зигзагообразные движения во все стороны. Этим же шпателем засевают вторую и третью чашки.
Посев жидких материалов на твердую среду в чашки Петри пипеткой. Определенный объем исследуемой жидкости (обычно 1 или 0,1 мл) вносят в стерильную чашку. Затем в эту же чашку вливают расплавленный и остуженный до температуры 45 °С мясопептонный агар и плавными движениями чашки на горизонтальной плоскости тщательно перемешивают среду с исследуемой жидкостью. После застывания агара чашку Петри, как обычно, перевертывают вверх дном и ставят в термостат. Выращивание микробов производят 24-48 ч при температуре, оптимальной для изучаемого вида микроорганизмов, чистую культуру которых выделяют.
Каждая микробная клетка, а также спора, попавшая в питательную среду из посевного материала, при застывании среды оказывается закрепленной на одном месте, начинает развиваться и дает колонию. Чем меньше колоний выросло на чашке и чем изолированнее одна от другой эти колонии, тем успешнее можно выделить чистую культуру микроба. Поэтому при посевах желательно брать посевной материал, содержащий как можно меньше микроорганизмов. С этой целью производят разбавление (разведение) материала.
Для разведения исследуемых материалов необходимо иметь достаточное количество стерильных пипеток емкостью 1 мл и стерильную воду в пробирках по 9 мл.
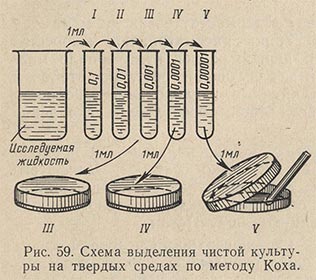
Техника разведения следующая (рис. 59). После тщательного перемешивания исследуемой пробы стерильной пипеткой отбирают 1 мл материала и вносят в пробирку с 9 мл стерильной воды. Работу проводят над пламенем горелки с соблюдением правил стерильности. Получают первое разведение в 10 раз. Осторожно перемешивают содержимое пробирки. Перемешивание можно произвести повторным всасыванием жидкости в пипетку и выпусканием ее обратно в пробирку. Из пробирки с первым разведением второй стерильной пипеткой переносят 1 мл в следующую пробирку, содержащую 9 мл стерильной воды. Получают второе разведение (в 100 раз). Эту операцию при необходимости производят и дальше, получая третье, четвертое, пятое разведения. Производить разведение более чем в 100 000 раз (пятое разведение) не рекомендуется, так как при слишком больших разведениях изучаемые микробы могут не попасть в отбираемую пробу, особенно в том случае, если количество их составляло относительно небольшой процент по отношению ко всей микрофлоре субстрата.
Выделение чистых культур аэробных микроорганизмов
Из каждого разведения 1 мл жидкости высевают в стерильную чашку Петри, заливая 10-15 мл расплавленного и охлажденного до 45 °С мясопептонного агара. Посев выращивают в термостате при температуре, оптимальной для изучаемых микроорганизмов, в течение 24-48 ч. Просматривая чашки Петри после выращивания, отбирают ту чашку, в которой выросшие колонии оказываются наиболее изолированными.
Однородность по внешнему виду выросших на чашке колоний свидетельствует о том, что посевной материал содержал микроорганизмы одного вида. Если же колонии оказываются неоднородными, то, следовательно, в посевном материале находилась смесь разнообразных микробов. Все выросшие колонии в этом случае нужно разбить на группы по однородности и изучать каждую группу однородных колоний в отдельности.
Из однородных колоний в чашке Петри выбирают одну изолированную колонию, из нее делают мазок и устанавливают чистоту культуры. Об этом будет свидетельствовать морфологическая однородность микробных клеток, наблюдаемых в поле зрения микроскопа. Оставшуюся часть колонии прокаленной и остуженной петлей с соблюдением правил стерильности пересевают (отвивают) на поверхность скошенного агара. Выросшая на косом агаре культура также должна давать однородный рост и при микроскопировании однородные клетки. В противном случае пересевы колоний с чашек Петри повторяют до тех пор, пока не убедятся в чистоте выделенной культуры.
Выделение чистых культур анаэробных микроорганизмов
Одним из основных условий при культивировании анаэробных микробов является удаление из питательной среды молекулярного кислорода, оказывающего токсическое действие на анаэробные культуры. Вторым обязательным условием, обеспечивающим выделение анаэробов из исследуемого субстрата, является внесение большого количества посевного материала в питательную среду.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды – в трубках Вейона. Средой накопления для анаэробов является среда Китта-Тароцци. Уже указывалось, что для создания анаэробных условий при приготовлении среды Китта-Тароцци на дно пробирок помещают кусочки печени. Можно использовать и круто сваренный белок куриного яйца.
Следует помнить, что перед посевом среду Китта-Тароцци нужно «регенерировать» – удалить возможно растворившийся в бульоне кислород. Для этого среду кипятят на водяной бане 15-20 мин, а затем быстро охлаждают погружая пробирки в холодную воду. В подготовленную среду Китта-Тароцци производят посев исследуемого материала стерильной градуированной или пастеровской пипеткой в количестве 1 мл.
Анаэробные микроорганизмы являются спорообразующими, поэтому при исследовании материалов, где предполагается наличие вегетативных форм, необходимо засеянные пробирки прогреть в водяной бане при 80 °С в течение 30 мин.
Посевы выдерживают в термостате при 37 °С в течение 5 суток. При наличии роста отмечают наступившее в среде Китта-Тароцци изменение: помутнение или помутнение и газообразование; из проросших пробирок делают мазки и окрашивают по Граму. Материал для мазков берут пастеровской пипеткой, которую опускают до дна пробирки.
При наличии в мазках спороносных палочек в виде ракеток, окрашивающихся в молодых 3-4-дневных культурах грамположительно, а в старых 5-7-дневных культурах грамотрицательно, при появлении в пробирке газа и запаха масляной кислоты (сырный запах) делают предположение о присутствии облигатных анаэробов. Для идентификации данного вида анаэроба материал из пробирки пересевают в полужидкий агар в трубки Вейона (см. «Метод Вейона для культивирования анаэробов»).
Высев из среды Китта-Тароцци можно производить и в чашки Петри, применяя метод последовательного разведения. В этом случае посевы необходимо выдерживать в анаэростатах или эксикаторах, на дно которых помещаются кислородпоглощающие вещества (смесь гидросульфита натрия с двууглекислой содой или щелочной раствор пирогаллола).
Главные принципы и особенности посева бактерий
Посев различных бактерий представляет собой один из наиболее эффективных и широко распространенных способов, который в настоящее время активно применяется в сфере медицинской микробиологии. Также данный метод незаменим в области биотехнологии, где он играет важную роль в изучении различных свойств как биологического, так и биохимического характера. Под данным методом подразумевается процесс культивирования микроскопических организмов с использованием питательных сред, различающихся между собой по характеристикам и свойствам.

Бактериологические посевы могут проводиться с целью тщательного исследования отделяемых клеток глаз, половых органов человека, а также с целью максимально точного анализа крови, мочи или кала. Также выполняются бактериальные посевы спермы и мокроты для исследования. Довольно часто встречается процедура посева на анаэробные бактерии.
Какими бывают среды для питания бактерий
При выборе среды для осуществления посева в первую очередь следует ориентироваться на характер содержания, присущего бактериям, которые являются главным объектом исследования. В том случае, если необходимо получить изолированные колонии бактерий, а также определить чистую культуру, следует выполнять посев на плотные питательные среды.
Но если материал, подверженный исследованию, содержит в себе не очень большое количество микроорганизмов, можно в этих целях использовать жидкую питательную среду.
Существует несколько разновидностей питательных сред, в которых осуществляется бактериальный посев. Итак, принято различать простые и специальные среды, а также элективные и дифференциально-диагностические. Каждая категория сред питания отличается своими индивидуальными особенностями и характеристиками.

Простые питательные среды, в свою очередь, бывают как плотными, так и жидкими. В первом случае это мясопептонный агар, а во втором – мясопептонный бульон.
Главной особенностью специальных сред является абсолютная замена основы либо смешивание ее с другим компонентом, обладающим специфическими свойствами и характеристиками. В результате такого процесса можно выделить следующие виды питательных сред:
- агар на основе сыворотки;
- агар на основе казеина и активированного угля;
- яичная среда, открытая бактериологами Леванштейном и Йенсеном;
- бульон на основе агара и стерильной дефибринированной крови кролика, лошади или барана.
Известны в микробиологии и элективные питательные среды, отличительной чертой которых является получение роста только того из микроорганизмов, который на данный момент представляет интерес для исследования.
К элективным средам относят:
- пептонную воду;
- щелочной агар;
- среду Мюллера;
- среду Леффлера;
- желточно-солевой агар;
- селенитовую среду.
С целью исследования сальмонелл бактерии высеиваются на селенитовую среду и среду Мюллера. Наиболее эффективной для работы с коринебактериями дифтерии признана питательная среда Леффлера. Для стафилококка бактерии высеивать необходимо на желточно-солевой агар, а для холерного вибриона – в пептонную воду.

При помощи дифференциально-диагностических питательных сред появляется возможность проведения максимально точной идентификации отдельно взятых категорий, групп и типов бактерий. Среди данных сред можно выделить два основных типа – это:
- среда Сабуро, для которой характерно добавление антибиотика;
- среды Гисса, также известные под названием «пестрый ряд».
Какие различают способы и техники посева
Принято различать несколько техник и методов посева. В большинстве случае данный процесс осуществляется при помощи специальных микробиологических петель. При посеве на специальные чашки Петри данный процесс происходит с применением особых игл или шпателей, изготовленных из стекла или металла. Такой инструмент, как бактериальная петля, можно с уверенностью назвать универсальным, поскольку он применяется в разных техниках бактериального посева. В случае с жидкими материалами применяют специальную петлю в сочетании с пипетками – пастеровскими или градуированными.
Инструмент под названием чашка Петри предназначен специально для осуществления посева на плотные питательные среды. Это выполненный в форме невысокого и плоского цилиндра лабораторный сосуд, изобретенный в 1877 году знаменитым немецким бактериологом Юлиусом Ризардом Петри, который являлся ассистентом микробиолога Роберта Коха. Для изготовления чашки Петри, как правило, используют стекло либо полистирол с прозрачной текстурой. Самый широко используемый размер чашки Петри – высота до 15 миллиметров и диаметр от 50 до 100 миллиметров.

В данном случае техника бактериального посева такова: немного приоткрывают крышку чашки Петри, а затем наносят на поверхность плотной питательной среды – агара – требуемое количество посевного материала.
После того как произойдет инкубация бакпосева, бактерии начнут расти густо и равномерно, превращаясь в полноценную культуру и подразделяясь на отдельные колонии.
В данном процессе можно использоваться как стеклянные, так и пластмассовые чашки Петри. Первый вид предназначается для многоразового, а второй – для одноразового применения. Пластиковые чашки Петри являются стерильными, а поставляют их в специальных надежных герметических упаковках. Стеклянные сосуды, в свою очередь, требуют тщательной стерилизации перед осуществлением каждого нового посева.
Если при бакпосеве на плотные среды применяются чашки Петри, то в случае с жидкими средами можно использовать пробирки. Бактериальный посев позволяет быстро вырастить культуру бактерий с определенными свойствами и характеристиками.
Особенности бактериального посева мочи
Анализ, подразумевающий бактериальный посев мочи, предназначается для выявления, идентификации различных микроорганизмов, а также позволяет определить точную их концентрацию. Чтобы провести данную процедуру, мочу, которая является в данном случае основным биоматериалом, помещают в специальную среду питания, которая окажется для нее максимально благоприятной. Если после этого микроорганизмы не начнут расти, результат анализа является отрицательным.
Если же после проведения такого анализа концентрация микроорганизмов в моче окажется достаточно высокой для их размножения, то его результат, бесспорно, положителен.

В каких случаях пациентам назначают анализ мочи с посевом бактерий?
Проведение анализа с бактериальным посевом мочи является актуальным в нескольких случаях:
- при наличии инфекционных заболеваний органов мочевыводящей системы;
- при заболевании сахарным диабетом;
- при беременности;
- с целью уточнения диагноза, если заболевание носит нетипичный характер.
Для проведения этого вида анализа требуется утренняя порция мочи пациента, приблизительное количество которой составляет от трех до пяти миллилитров. Перед сбором мочи на анализ пациент должен обязательно провести соответствующие гигиенические процедуры, однако применять при этом средства с антисептическими свойствами нельзя. Доставку собранной мочи для анализа необходимо производить в кратчайшие сроки. С этой целью применяется стерильный одноразовый контейнер, который гарантирует правильную транспортировку и максимально точные результаты.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
Методы стерилизации питательных сред и посуды, микробиология
Методы стерилизации питательных сред и посуды, микробиология / Methods of sterilization of nutrient media and dishes, microbiology
Стерилизация является одним из важнейших и необходимых приемов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает обеспложивание. В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Различают термическую и холодную стерилизацию. Способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Методы холодной стерилизации: стерилизация фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Физико-химические свойства материала и стерилизация / Physical and chemical properties of the material and sterilization
Возможность и целесообразность применения того или иного способа определяется в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
Стерилизация питательных сред насыщенным паром под давлением (автоклавирование) Совместное действие высокой температуры и давления пара обеспечивает особую эффективность данного способа (табл. 1).
Температура насыщенного пара при разных давлениях Давление Температура, нормальное, атм кПа °С 1,0 101,32 100 1,5 151,98 111 2,0 202,65 121 2,5 251,20 128 3,0 299,75 134 При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдержи6 вают и 5-минутную экспозицию в насыщенном паре при 121 °С.
Стерилизацию текучим паром под давлением осуществляют в автоклавах. Автоклав представляет собой металлический двустенный резервуар, способный выдерживать высокое давление, в который помещают стерилизуемый материал на специальную подставку. Предметы следует размещать не слишком плотно, так как пар должен проходить между ними, иначе они не нагреваются до нужной температуры и могут остаться нестерильными. По окончании времени стерилизации автоклав открывают, когда давление в нем сравняется с атмосферным. Преждевременное открывание крана автоклава недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает впоследствии стерильность материала. К работе с автоклавом допускаются только подготовленные лица! Подготовка сред к стерилизации.
При автоклавировании 3 – 5 % жидкости теряются в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5% дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях.
Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками с бумажными колпачками. Стеклянные, резиновые, корковые и другие пробки завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой. Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111-138 °С, т.е. от 0,5 до 2,5 атм. Температура ниже 111 °С не может считаться надежной; а выше 138 0С, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атм. Температура и длительность автоклавирования питательных сред определяются, прежде всего, их составом, термоустойчивостью или термолабильностью компонентов.
Стерилизация легко разрушающиеся субстраты при 0,5 атм в течение 15-30 мин / Sterilization of easily degraded substrates at 0.5 atm for 15-30 minutes
Внимание! Легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, 7 витамины (пивное сусло, соки, дрожжевой автолизат и др.) обычно стерилизуют при 0,5 атм в течение 15-30 мин.
Мясопептонные среды можно стерилизовать при 1,0 атм 20 мин. С трудом поддаются стерилизации в автоклаве различные порошки (например тальк) и вязкие жидкости (глицерин, вазелиновое масло), поэтому их лучше стерилизовать в сушильных шкафах при 160 °С в течение 2 или 1 ч при 170 °С. В этом случае слой масла или порошка в сосуде не должен превышать 1,5 см. После автоклавирования среды для проверки стерильности выдерживают 2 – 3 сут в термостате при 30 0С. Если в средах обнаруживается рост микроорганизмов, их готовят заново.
Дробная стерилизация (тиндализация) и пастеризация Тиндализация, дробная стерилизация, была предложена в 1877 г. Тиндалем. Она применяется для сред, портящихся под действием температур выше 100 °С. Тиндализацию осуществляют текучим паром а автоклаве с незавинченной крышкой или в аппарате Коха. Среды прогревают несколько раз по 10 – 15 мин. Между прогреваниями среды ставят в термостат при температуре 3 0 0 С н а 8 – 1 2 ч для прорастания жизнеспособных спор. Среды, не выдерживающие нагревания при 100 °С, прогревают более осторожно при 60 – 80 °С через каждые 8 – 1 2 ч 4 – 5 дней подряд. Однократный прогрев материала при температуре ниже 100 0С известен под названием пастеризация. Этот метод, предложенный Пастером, предназначен для уничтожения только бесспоровых форм микроорганизмов. Следовательно, в подавляющем большинстве случаев он не обеспечивает стерильности.
Пастеризацию проводят при 60-80 0С 10 – 30 мин. Этот процесс используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.
Стерилизация фильтрованием Фильтрованием стерилизуют синтетические среды строго определенного состава, которые содержат легкоразрушающиеся или летучие компоненты – витамины, аминокислоты (цистеин и цистин), белки, углеводы, антибиотики и др. Фильтрование жидкостей осуществляют через мелкопористые материалы, легко адсорбирующие клетки микроорганизмов: асбест, целлюлозу, фарфор, каолин и др.
Стерилизующими фильтрами теоретически считают такие, размер пор которых не превышает 0,20 мкм. Наиболее широкое распространение в микробиологической практике получили мембранные фильтры, которые в зависимости от величины пор применяют для фильтрования и стерилизации. Для стерилизации используют отечественные фильтры фирм «Владипор», «Владисарт» с диаметром пор 0,20 мкм. Плотные диски, изготовленные из смеси асбеста с целлюлозой, называются фильтрами Зейтца. В зависимости от диаметра пор они обозначаются разными индексами.
Стерилизующими являются СФ-3 и СФ-4. Мембранные фильтры стерилизуют автоклавированием при 1 атм 15 мин или длительным кипячением. Стерилизация стеклянной посуды. Основным способом стерилизации стеклянной посуды является обработка ее сухим горячим воздухом при температуре не выше 180 ° в течение 1 – 3 ч (табл. 2). При этом погибают и вегетативные клетки, и споры микроорганизмов. Стерилизацию осуществляют в специальных суховоздушных (сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации и обеспечивающих автоматическое поддержание необходимой температуры.
Таблица 2 Время, необходимое для стерилизации стеклянной посуды сухим жаром Температура, °С Время, мин 140 180 150 150 160 120 170 60 Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. После этого еѐ загружают в стерилизатор (или в сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться. Стерилизация инструментов и приборов.
Стерилизация прокаливанием в пламени перед использованием, металлические инструменты / Flame sterilization before use, metal tools
Внимание! Мелкие лабораторные металлические инструменты – петли, иглы, пинцеты, ножницы, шпатели – стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием.
На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при посевах культур и разливе сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов. Шприцы лучше всего стерилизовать сухим жаром при 160 0С либо в собранном, либо в разобранном виде. В первом случае длительность стерилизации 75, во втором – 60 мин. Собранные шприцы вместе с иглой стерилизуют в пробирке, закрытой ватной пробкой, разобранные заворачивают в бумагу или ткань.
Можно стерилизовать шприцы и в автоклаве при 1 атм в течение 15-20 мин. Автоклавируют их только в разобранном виде, иначе они повреждаются.
Стерилизация газообразными веществами / Sterilization with gaseous substances
Лабораторную аппаратуру, имеющую зеркальное, оптическое и радиоэлектронное оборудование, а также изделия из термолабильных пластмасс, например центрифужные пробирки, стерилизуют газовым методом. Для газовой стерилизации применяются только те соединения, которые обладают спороцидными свойствами. Это оксид этилена, метилбромид, оксид пропилена, формальдегид, глютаральдегид, бета-пропиолактон, озон и др. Газовую стерилизацию проводят в специальных герметически закрывающихся аппаратах.
Стерилизуемые объекты, помещаемые в камеру, упаковывают как при стерилизации в автоклаве или сушильном шкафу. При проведении газовой стерилизации строго соблюдают правила работы с ядовитыми газообразными веществами. Стерилизация облучением Для стерилизации помещений, оборудования, некоторых медицинских принадлежностей, пищевых продуктов используют различные виды излучений: инфракрасное, ультрафиолетовое, рентгеновские лучи, а-, Р- и у-лучи радиоактивных элементов. Чаще других в микробиологической практике используют ультрафиолетовое облучение. Мощность ультрафиолета измеряется в бактах. Доза УФ-излучения, губительная для различных видов микроорганизмов (кроме спор), составляет 5 мкб/см2
Купить растворы для микробиологии в Санкт-Петербурге , Microbiology
В каталоге химической продукции Химснаб-СПБ представлены товары для микробиологических исследований, фиксаторы-красители, для определения приготовления рабочийх раствоов растворы для микробиологии, категории: solutions for Microbiology, готовые растворы для микробиологии (ready solutions for microbiology), исследование гистологических препаратов (histological preparations), микроскопирование (microscopy).
растворы для микробиологии
растворы для микробиологии
Подробнее. Купить растворы для микробиологии различного объема. Готовые растворы для микробиологии по выгодной цене. Растворы – цитологический метод (cytological method) окрашивания микроорганизмов, клеточных структур и тканей различных видов.
Лабораторное оборудование для микробиологической лаборатории. микробиологическое оборудование
В компании Химснаб-СПБ можно подобрать по характеристиками и приобрести лабораторное оборудование для серологической (иммунологической) лаборатории, для осуществления различных лабораторных исследований: микробиологических исследований ; биохимических исследований ; молекулярно-биологических исследований . Подбор лаб. оборудования зависит от объектов исследования и целевой направленности научные исследования, диагностика заболеваний. Изучение иммунного ответа и серодиагностика заболеваний в иммунологических и серологических (serum — сыворотка крови) лабораториях. Приборы и оборудование для бактериологических, вирусологических, микологических и серологических (иммунологических) лаборатории.
Купить стерилизаторы, sterilizers в Санкт-Петербурге
В каталоге товаров/продукции представлены стерилизаторы – стерилизаторы воздушные, сухожаровые, стерилизаторы паровые, категории: sterilizers air, sterilizers steam, ; , ,
стерилизаторы воздушные, сухожаровые
стерилизаторы воздушные, сухожаровые
Подробнее. Купить стерилизаторы воздушные, сухожаровые – sterilizers air в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Стерилизатор может быть использован для дезинфекции и сушки медицинских изделий. Основное предназначение сухожаровых стерилизаторов воздушных: стерилизация хирургических инструментов, стерилизация стеклянной посуды, стерилизация термостойких шприцев (с отметкой 20.
стерилизаторы паровые
стерилизаторы паровые
Купить термостатирующее оборудование (термостаты), temperature equipment (thermostats) в Санкт-Петербурге
В каталоге товаров/продукции представлены термостатирующее оборудование (термостаты) – инкубаторы, термостаты, категории: incubators, thermostats, ; лабораторные приборы для поддержания заданной температуры, автоматические лабораторные инкубаторы, ,
инкубаторы
инкубаторы
термостаты
термостаты
Подробнее. (plugin.block types_of_thermostats) Купить термостаты – thermostats в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить в Санкт-Петербурге по выгодной цене. Современные приборы позволяющие поддерживать постоянную, заданную температуру (поддержание определенного температурного баланса). Используются в различных видах деятельности: физических, химических исследований, примен.
Купить шкафы сушильные, drying cabinets в Санкт-Петербурге
В каталоге товаров/продукции представлены шкафы сушильные – СНОЛ, другие сушильные шкафы, категории: ovens SNOL, other ovens, ; оборудование для контроля температуры и влажности, электропечь, сушильный шкаф, ,
Подробнее. (plugin.block ovens_heating_temperature) Объем рабочей камеры может составлять: 40-60 дм3. Купить СНОЛ – ovens SNOL в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить сушильный шкаф в Санкт-Петербурге по выгодной цене. шкафы сушильные drying cabinets шкафы сушильные, drying cabinets СНОЛ СНОЛ оборудование для контроля температуры и влажности, лабораторная электропеч.
другие сушильные шкафы
другие сушильные шкафы
Подробнее. (plugin.block ovens_heating_temperature) Широчайший выбор лабораторных сушильных шкафов. Купить шкафы сушильные для быстрого и равномерного нагрева, объемом сушильной камеры от 20 до 1000 л – drying cabinets в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Средней наивысшей точкой нагрева данных моделей является температура 300°С. Отдельные модели приборов снабжаются обратным таймером.
Купить перемешивающие устройства, magnetic stirrers в Санкт-Петербурге
В каталоге товаров/продукции представлены перемешивающие устройства – магнитные мешалки, шейкеры (встряхиватели), верхнеприводные мешалки, категории: magnetic stirrers, the shakers (shakers), overhead stirrers, ; магнитные мешалки, шейкеры, встряхиватели, ,
магнитные мешалки
магнитные мешалки
Подробнее. Современное электрическое лабораторное оборудование для бесшумного перемешивая жидкостей, растворов в малом объеме находящее свое применение в фармацевтических, клинических, медицинских, исследовательских и научных лабораториях. Лабораторное устройство, которое использует вращающееся магнитное поле для того, чтобы мешалка (или якорь), погруженный в жидкость или раствор, вращалась очень быстр.


