Анализ на ПСА (простатический специфический антиген)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
ПСА общий (простатический специфический антиген общий): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания к назначению исследования
Простатический специфический антиген (ПСА) секретируется эпителиальными клетками канальцев предстательной железы. В сыворотке крови он содержится в двух формах – свободной (10%) и связанной с различными антипротеазами (90%). Свободная и связанная фракции составляют общий простатический специфический антиген. Известно, что с возрастом концентрация ПСА увеличивается.
У простатического специфического антигена есть несколько физиологических функций: он разжижает семенной сгусток после эякуляции, выделяет особую субстанцию, которая стимулирует сокращение гладкой мускулатуры семенных пузырьков, обладает ингибирующим (замедляющим) действием на рост клеток, проявляя антиканцерогенный и антиангиогенный эффекты.
Увеличение концентрации сывороточного ПСА при раке простаты происходит из-за роста опухолевых клеток, разрушения пораженного органа и попадания антигена в общий кровоток.
Сывороточный уровень ПСА может повышаться не только при раке предстательной железы, но и при ее доброкачественной гиперплазии (ДГПЖ), и при хроническом простатите, поэтому простатический специфический антиген – это органоспецифический, но не опухолеспецифический маркёр.
Концентрацию ПСА выше 4 нг/мл обнаруживают примерно у 80-90% больных раком предстательной железы и у 10-20% больных аденомой простаты. Повышение уровня ПСА не всегда говорит о злокачественности процесса – значение имеет скорость нарастания концентрации ПСА (при раке это происходит быстрее).
Факторами риска развития рака предстательной железы считают генетическую предрасположенность, возраст мужчины и особенности питания.
Существует связь между уровнем простатического специфического антигена и степенью злокачественности процесса и метастазированием. Так, при значении ПСА выше 50 нг/мл у большинства пациентов может наблюдаться выход онкологического процесса за капсулу органа и поражение регионарных лимфатических узлов.
Мониторирование концентрации ПСА помогает специалистам обнаружить рецидив (возвращение проявлений заболевания по причине неполного выздоровления) или метастазирование (процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани и/или органы). Например, после простатэктомии (удаления предстательной железы) ПСА должен определяться в крови не выше уровня остаточной концентрации от 0,05 до 0,1 нг/мл. Концентрация ПСА выше этого уровня может свидетельствовать об остаточной опухолевой ткани или метастазах. При этом рекомендовано определять ПСА через 60-90 дней после удаления простаты в связи с возможными ложноположительными результатами.
Эффективность терапии (например, лучевой, гормональной) определяется значимым снижением концентрации ПСА.
Таким образом, показаниями к проведению исследования уровня простатического специфического антигена являются:
- ранняя диагностика рака предстательной железы;
- решение о целесообразности проведения биопсии простаты;
- мониторинг течения заболевания;
- оценка эффективности проводимой терапии рака простаты;
- диагностика метастазирования.
Подготовка к процедуре
Предпочтительно выдержать 4 часа после последнего приема пищи.
Анализ следует проводить до или не ранее чем через 6-7 дней после массажа или пальцевого ректального обследования простаты, трансректального УЗИ, биопсии, лазерной терапии, эргометрии, цистоскопии, колоноскопии, после любых других механических воздействий на простату.
Срок исполнения
До 1 рабочего дня, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может оказаться некорректным.
Повышенная концентрация ПСА может наблюдаться в течение 10 дней после пальцевого ректального исследования, цистоскопии, колоноскопии, трансуретральной биопсии, простатэктомии или массажа простаты, лазерной терапии, при задержке мочи, эякуляция накануне исследования.
На уровень общего ПСА могут влиять лекарственные препараты – антагонисты андрогенов, аллопуринол, финастерид, циклофосфамид, метотрексат.
ПСА общий (Простатический специфический антиген общий, Prostate-specific antigen total, PSA total)
Исследование общего ПСА в сыворотке крови используют для скрининга рака предстательной железы и оценки целесообразности проведения биопсии. Тест применяют также для контроля эффективности лечения и выявления рецидивов рака простаты.
Простат-специфический антиген и брахитерапия
Простат-специфический антиген (ПСА) является маркером, который используется для диагностики и раннего выявления рака предстательной железы. Он обладает достаточно высокой чувствительностью и специфичностью для того, чтобы заподозрить наличие заболевания на начальных стадиях.
Помимо первичной диагностики, уровень ПСА имеет огромное значение при последующем диспансерно-динамическом наблюдении за пациентами, которым проведено какое-либо лечение по поводу рака простаты: лучевая или гормональная терапия, операция. Высокодозная брахитерапия не является исключением.
Очевидно, что после брахитерапии уровень простат-специфического антигена должен снижаться по сравнению с его исходным показателем. Динамика этого снижения и минимальный уровень, до которого он опускается, имеют большое значение для определения эффективности проведенного лечения. При этом необходимо помнить, что определение уровня ПСА желательно производить в одной и той же лаборатории, так как используемые тест-системы обладают различной чувствительностью, что объясняет возможные значимые расхождения показателя при одновременном заборе у одного и того же пациента в разных лабораториях.
Определение уровня ПСА является методом самой ранней диагностики возможного рецидива (биохимического) рака предстательной железы после брахитерапии и служит основанием к назначению других более сложных и дорогостоящих методик:
- магнитно-резонансная томография
- остеосцинтиграфия
- позитронно-эмиссионная томография.

Динамика ПСА после брахитерапии
При определении уровня простат-специфического антигена после высокодозной брахитерапии необходимо помнить три важных нюанса:
- Временный подъем ПСА
Брахитерапия вызывает разрушение опухолевых клеток в предстательной железе, что на первом этапе может сопровождаться временным подъемом ПСА по сравнению с исходным его значением. Это и обуславливает необходимость сдачи первого контрольного анализа после окончания лечения не ранее чем через 3 месяца.Последующие определения уровня простат-специфического антигена также осуществляются 1 раз в 3 месяца в течение нескольких лет. - Снижение ПСА может быть длительным
Процесс снижения ПСА после лучевой терапии (брахитерапии) может быть длительным в отличие от радикальной простатэктомии, когда уже к исходу первого месяца после операции, как правило, показатель достигает низшего своего значения. Это объясняется тем, что предстательная железа сохраняется и продолжает вырабатывать незначительное количество простат-специфического антигена. Описаны случаи постепенного снижения уровня ПСА после лучевой терапии в течение 5 лет наблюдения. - У 30% пациентов возможны периоды повышения ПСА
Это так называемый феномен «доброкачественного рецидива» или «биохимического скачка». При этом уровень маркера повышается незначительно (несколько десятых нг/мл) и носит временный характер. В его основе так же лежит представление о том, что предстательная железа сохраняется и продолжает вырабатывать незначительное количество простат-специфического антигена. Как правило, он наблюдается у пациентов с большим объемом простаты и выраженной сопутствующей доброкачественной гиперплазией (аденомой).
Высокие показатели ПСА после брахитерапии
Рост ПСА более 2 нг/мл относительно низшего его значения, достигнутого после лечения, в настоящее время является общепризнанным определением рецидива заболевания при лучевой терапии, к которой относиться и высокодозная брахитерапия. Абсолютное значение этой низшей точки уровня ПСА строго индивидуально и во многом зависит от исходных клинических показателей опухоли (местная распространенность процесса, степень злокачественности).


Авторская публикация:
НОВИКОВ СЕРГЕЙ НИКОЛАЕВИЧ
радиолог, онколог, радиотерапевт
ведущий научный сотрудник, заведующий отделением
НИИ онкологии им Н.Н. Петрова
Что вам необходимо сделать
- Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
- Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте, Instagram, Facebook, YouTube и Одноклассники.
- Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки:
Публикации по теме:
Очень ценная информация, особенно для тех, кто прошел лучевую терапию простаты. Хотелось бы только узнать, как долго держится боэнс или это всё сугубо индивидуально? Скачок бывает однократным или может повторяться? Если повторяется, то с какими интервалами? Где найти ответы на эти и подобные вопросы, м.б., более развернуто?
А вообще, хорошо, что отделение радиологии готовит такую информацию. Спасибо.
у меня ПСА 0,00 это хорошо?
Добрый день!мой муж прошёл облучение киберножом в 2015 году.с этого года он каждые три месяца сдавал ПСА.результаты разные в течение 2015-2020 гг. от 0,2 до 0,9.В 2022 году показатели 0,89.Это хорошо?он переживает что это идёт рост.Спасибо.
Рак простаты у мужчин: прогнозы
Когда диагностируют рак простаты у мужчин, прогноз выживаемости зависит от формы рака, стадии развития опухоли, состояния здоровья и возраста больного. Выживаемость при раке простаты выше, если опухоль обнаружена на раннем этапе развития. Ранние стадии развития злокачественного новообразования относятся к локальным видам рака – опухоль не выходит за пределы органа, нет метастазов. Заболевание хорошо поддается лечению. Когда диагностирован метастазирующий рак простаты, последствия тяжелые – заболевание хуже поддается лечению, в костях, печени, легких, лимфатических узлах обнаруживаются метастазы опухоли, больной ослаблен, часто подавлен.
В Юсуповской больнице проводят лечение рака простаты на всех стадиях развития. Пациент проходит обследование у уролога, онколога, получает помощь психолога. В больнице пациент со злокачественными заболеваниями простаты может пройти диагностику на инновационном медицинском оборудовании, получить все виды медицинской помощи в зависимости от типа опухоли, стадии развития новообразования. В реабилитационном центре пациенты проходят восстановление по специальной программе для онкологических больных.

Симптомы рака простаты
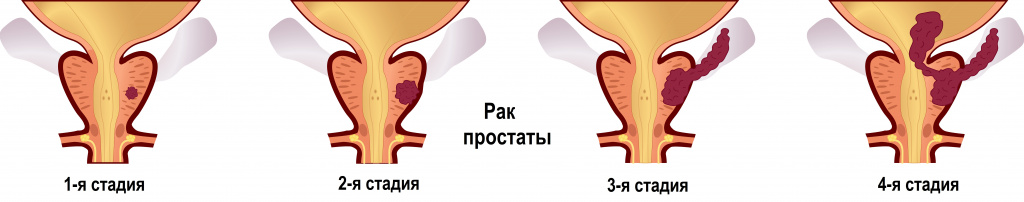
Предстательная железа – это орган, состоящий из нескольких частей. Железа находится в капсуле, части железы разделены эластичными перегородками. Предстательная железа участвует в выработке семенной жидкости, которая служит питательной средой для сперматозоидов, участвует в выработке сперматозоидов, отвечает за качество спермальной жидкости, за функцию выведения спермы наружу, за эректильную функцию, за задержку мочи. Рак предстательной железы распространенное заболевание, занимающее одно из первых мест среди злокачественных заболеваний. Признаки рака простаты достаточно размыты. Из-за бессимптомности на начальных стадиях развития и схожести симптомов с симптомами аденомы простаты, рак простаты чаще диагностируют на 3-4 стадии развития, когда появляются выраженные симптомы заболевания, нарушается мочеиспускание, нарушается процесс дефекации, эрекция, появляется боль в области поясницы, низа живота, костях.
Симптомы локального рака простаты на первой стадии – это небольшое увеличение предстательной железы, изредка возникает дискомфорт во время мочеиспускания. На стадии Т1а и 1b локальные опухоли простаты не пальпируются из-за небольшого объема новообразования, чаще всего представляют собой высокодифференцированные опухоли. В некоторых случаях определяется хорошо дифференцированный рак (обнаруживаются раковые клетки менее чем в 5% исследуемых тканей). Если ПСА находится в пределах нормы, устанавливают динамическое наблюдение за больным. Локальный рак простаты может представлять собой латентную форму рака, которая никогда не переходит в клинические формы заболевания.
Рак простаты на раннем этапе обнаруживается редко, основным методом, который помогает выявить злокачественное заболевание простаты на ранней стадии, считается тест ПСА. Характеристика злокачественной опухоли простаты по стадиям:
- Стадия Т1 – опухоль может чувствоваться при пальцевом исследовании, часто не обнаруживается при трансректальном ультразвуковом исследовании.
- Стадия Т1а – в большинстве случаев рак обнаруживают при гистологическом исследовании после удаления ткани аденомы простаты. Исследование показывают небольшое содержание раковых клеток – не более 5%.
- Стадия Т1b – Раковые клетки выявлены при гистологическом исследовании после лечения аденомы простаты. В отличие от стадии Т1а в тканях простаты более 50% раковых клеток.
- Стадия Т1с – тест на ПСА показал повышенный уровень, гистологическое исследование показало наличие рака простаты.
- Стадия Т2 – опухоль чувствуется при ректальном исследовании, её диагностируют с помощью УЗИ, КТ и других методов исследования. Опухоль не выходит за пределы простаты.
- Стадия Т2а – на этой стадии рак поражает половину или чуть менее половины доли простаты.
- Стадия Т2b – раковая опухоль поражает более половины доли органа.
- Стадия Т2с – рак поражает обе доли предстательной железы.
- Стадия Т3 – опухоль выходит за пределы органа, нередко поражает семенные пузырьки.
- Стадия Т3а – рак выходит за пределы органа, но не поражает семенные пузырьки.
- Стадия Т3b – злокачественная опухоль поражает семенные пузырьки.
- Стадия Т4 – опухоль выходит за пределы простаты, поражает мышцы мочевого пузыря, прямую кишку, стенку таза и другие органы, и ткани.
Лечение рака предстательной железы
Лечение рака на стадиях Т1с-Т2с проводится в зависимости от возраста больного. Хирургическое лечение рака простаты не показано мужчинам после 70 и старше. Не назначают хирургическое лечение пожилым мужчинам с сопутствующими раку простаты тяжелыми заболеваниями, при наличии высокодифференцированной опухоли. В большинстве случаев радикальная простатэктомия назначается молодым мужчинам. В старшем возрасте поддержка больного проводится с помощью лучевой терапии и химиотерапии. При повышении уровня ПСА после радикальной простатэктомии назначают адъювантную терапию. Повышение уровня ПСА указывает на развитие рецидива опухоли простаты или метастазы.
Третья стадия рака простаты характеризуется появлением стойкого нарушения мочеиспускания из-за увеличения простаты, располагающейся вокруг уретры. После проведения радикальной операции назначают адъювантную лучевую терапию при Т3 с показателями суммы Глисона больше 7 баллов, уровня ПСА более 10, если доказан местный рецидив опухоли простаты. Лучевая терапия показана пациентам с локальными формами рака простаты на первой и второй стадии заболевания, в случае невозможности или нежелания проведения хирургического лечения, а также больным со стадией Т3 и отсутствием метастазирования опухоли в регионарные и отдаленные лимфоузлы. Для проведения лучевой терапии пациент должен иметь прогноз долгой продолжительности жизни. Для повышения эффективности используют комбинированное лечение: лучевая терапия + гормональная терапия.
Использование адъювантной гормональной терапии оправдано у пациентов с диплоидными опухолями. Для лечения Т1-Т2 также применяют брахитерапию – облучение простаты путем введения радиоактивных гранул. Пациентам со стадией Т3 брахитерапию проводят в комплексе с наружным облучением. В случае если опухоль простаты обнаружена у мужчины в возрасте, при наличии сопутствующих тяжелых заболеваний, высокодифференцированном раке простаты в стадии Т1а, Т1с оправдано динамическое наблюдение. В случае прогрессирования опухоли принимается решение о методах лечения с учетом возраста, состояния здоровья больного.
3 степень: продолжительность жизни
При обнаружении 3 стадии рака простаты прогноз зависит от наличия или отсутствия метастазирования опухоли, распространенности процесса, агрессивности рака предстательной железы. Прогноз при средней тяжести заболевания ставить сложнее, чем при ранних стадиях рака. Прогноз на поздних стадиях неблагоприятный, четвертая стадия заболевания относится к неизлечимой стадии рака. Рак предстательной железы 3 стадия – прогноз выживаемости в течение пяти лет после проведения лечения составляет 40%.
2 степень: продолжительность жизни
Рак простаты 1 степени – продолжительность жизни (в течение пяти лет) после лечения рака составляет 90%. Рак простаты 1 степени хорошо поддается лечению, но обнаружение опухоли редко происходит на первой стадии развития. В большинстве случаев рак диагностируют во время гистологического исследования тканей после резекции аденомы простаты, а также с помощью теста ПСА.
Прогноз выживаемости при онкологии простаты
Рак предстательной железы – это тяжелое заболевание, которое бессимптомно протекает на ранних стадиях развития, агрессивные опухоли простаты развиваются стремительно, быстро приводят к смерти больного. Прогноз выживаемости при раке рассчитывается исходя из пятилетнего срока, в зависимости от стадии и агрессивности опухоли определяется прогноз пятилетней выживаемости больного. Прогноз составлен на основании выживаемости определенного процента пациентов после постановки первичного диагноза. В прогноз выживаемости не вошли пациенты, у которых в течение пятилетнего срока произошли рецидивы рака.
Прогноз выживаемости имеет показатель относительной выживаемости. Расчет относительной выживаемости проводился по пациентам, которые страдали раком определенной локализации, а смерть наступила от сопутствующих раку заболеваний. Для прогноза выживаемости важны такие критерии, как стадия рака, локализация опухоли, возраст, пол, чувствительность к препаратам, наличие сопутствующих заболеваний.
2 степень: продолжительность жизни
Рак предстательной железы 2 степени – продолжительность жизни в течение пяти лет составляет 80%. Выживаемость при раке простаты 2 стадии высокая, опухоль хорошо поддается лечению на этой стадии, успех лечения рака зависит от опыта врача-онколога, эффективности назначенного лечения.
Средняя продолжительность жизни
Продолжительность жизни больных раком простаты зависит от многих факторов: состояния здоровья больного, стадии рака, психологического состояния больного, эффективности лечения и многих других составляющих прогноза выживаемости. Часть больных излечивается полностью на ранних стадиях развития рака, у части больных происходят рецидивы, рак метастазирует – прогноз выживаемости ухудшается. При своевременном обращении к врачу продолжительность жизни составляет 15 и более лет. Неблагоприятный прогноз для рака простаты 4 степени: продолжительность жизни при постоянном паллиативном лечении не более 7 лет. Рак предстательной железы 4 степени – продолжительность жизни в течение пяти лет отмечена у 15% больных.
Гормонозависимая злокачественная опухоль простаты – срок жизни
Повышение уровня тестостерона в организме мужчины может привести к развитию гормонозависимого рака предстательной железы. Прогноз выживаемости при такой форме рака негативный. Опухоль отличается быстрым прогрессом, при появлении метастазов продолжительность жизни при раке простаты этого типа составляет не более 3-4 лет. Если обнаружена онкология предстательной железы, прогноз выживаемости составляется после полного обследования пациента, постановки диагноза.
В Юсуповской больнице проводится комплексная диагностика рака простаты. Определяется вид злокачественного заболевания и стадия развития опухоли. Диагностика заболевания проходит с помощью различных методов исследования:
- Тест ПСА. Проводится анализ крови на онкомаркер рака предстательной железы. Этот анализ позволяет выявить злокачественную опухоль на первой стадии развития. Ежегодно анализ назначают мужчинам, которые имеют наследственную предрасположенность к раку простаты.
- Проводится осмотр пациента врачом-урологом или онкологом. Врач выполняет ректальную пальпацию, определяя наличие образования, его локализацию, размер.
- Назначается трансректальное УЗИ предстательной железы.
- Для определения степени прорастания опухоли в соседние ткани, наличия метастазов в регионарных или отдаленных лимфатических узлах и органах врач направляет пациента на МРТ, КТ или ПЭТ-КТ исследования.
- После проведенных исследований назначают биопсию тканей простаты, пораженных опухолью.
В зависимости от показателей исследований, возраста, состояния здоровья пациента врач-онколог назначает лечение. В онкологическом отделении больницы применяют инновационные методы лечения рака простаты. Записаться на консультацию к врачу можно по телефону.
Мониторинг больных раком предстательной железы после лечения высокоинтенсивным сфокусированным ультразвуком (HIFU)
Фомкин Р.Н., Маслякова Г.Н., Блюмберг Б.И., Воронина Е.С., Седова Л.Н., Абрамова Э.П.
ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России, НИИ фундаментальной и клинической уронефрологии
Резюме
На основании анализа результатов обследования и оперативного лечения методом HIFU аблации 141 пациента с морфологически доказанным при биопсии локализованным и местнораспространенным раком предстательной железы разработана оптимальная схема наблюдения больных после лечения рака предстательной железы высокоинтенсивным фокусированным ультразвуком. Установлено, что мониторинг концентрации ПСА (nadir ПСА к 3 месяцам, динамика изменения концентрации ПСА) имеет большое значение в раннем выявлении рецидива после HIFU-терапии простаты.
Ключевые слова
высокоинтенсивный сфокусированный ультразвук (HIFU), рак предстательной железы, ультразвуковая хирургия
Статья
Рак предстательной железы — злокачественная опухоль, которой с каждым годом уделяется всё больше внимания. Это обусловлено тем, что быстрыми темпами увеличивается заболеваемость, особенно у мужчин пожилого возраста. Ежегодно в мире регистрируется 543 000 новых случаев рака предстательной железы. На его долю в структуре онкологической заболеваемости приходится 10,2%. 76,5% случаев рака простаты регистрируется в развитых странах [1,3].
С усилением скринингового контроля населения и внедрением современных методов диагностики (определения ПСА, трансректального ультразвукового исследования, магнитно-резонансной томографии, полифокальной биопсии) число впервые диагностированных случаев РПЖ быстро увеличивается, при этом значительно возрос процент пациентов с локализованной формой заболевания [2].
Для лечения больных с ожидаемой продолжительностью жизни менее 10 лет, а также для тех, кто отказался от открытой операции из-за возможных осложнений и для пациентов с тяжелым интеркуррентным фоном, предложен ряд альтернативных методов. Хорошие результаты получены при использовании трехмерного конформного облучения, брахитерапии, криоаблации предстательной железы. Однако в случае недостаточной эффективности (при местном рецидиве заболевания) повторное применение данных методик невозможно, а выполнение радикальной простатэктомии приводит к развитию большого числа осложнений [5].
Появление HIFU – терапии (высокой интенсивности фокусированный ультразвук – High Intensity Focused Ultrasound — HIFU) — нового малоинвазивного метода лечения рака предстательной железы — оказалось весьма своевременным и востребованным. В мировой периодической печати появляются публикации, в которых анализируется его эффективность, определяются показания к применению; несомненно, это сравнительно новый метод, требующий дальнейшего изучения и более длительного периода послеоперационного наблюдения [4].
В настоящее время не существует абсолютно эффективного метода лечения рака простаты, местный рецидив возможен после любого из них. Однако только HIFU позволяет осуществить повторную операцию практически после каждого из них. Схемы оценки эффективности HIFU-терапии до настоящего времени не разработаны. Неясны сроки контроля ПСА, биопсии предстательной железы и значение ТРУЗИ в мониторинге [6,8].
В литературе не в полной мере отражена динамика изменений при ультразвуковой эхографии после HIFU. Нет данных, оценивающих роль ультразвуковой томографии и цветового допплеровского картирования в оценке эффективности HIFU и ранней диагностике рецидива у больных раком предстательной железы. К настоящему моменту существующие методы исследования не позволяют точно диагностировать ранние местные рецидивы рака после сеанса HIFU. После лечения трансректальное ультразвуковое исследование показывает значительное уменьшение объема простаты и утрату зональной анатомии с потерей границ опухолевого узла и гетерогенной паренхимой, что затрудняет интерпретацию результатов. Применение магнитно-резонансной томографии с контрастированием позволяет определить ткань, подвергшуюся лечебному воздействию, но не позволяет четко дифференцировать среди гетерогенной зоны тканевой деструкции оставшуюся раковую ткань. В настоящее время местные рецидивы диагностируются с помощью рутинных пункционных биопсий простаты, выполняемых в плановом порядке после лечения и в случае повышения уровня ПСА [7,9].
Цель исследования: Разработать оптимальную схему наблюдения больных после лечения рака предстательной железы высокоинтенсивным фокусированным ультразвуком.
Материал и методы
Объектом исследования явились 141 больной с морфологически доказанным при биопсии локализованным и местнораспространенным РПЖ, находившихся на лечении в клинике урологии Клинической больницы имени С.Р. Миротворцева СГМУ в период с февраля 2009 г. по март 2012 г., которым проведено 141 сеанс первичного оперативного лечения рака простаты методом HIFU аблации.

Рис. 1. Распределение пациентов по стадии заболевания и группам онкологического риска
- Стадия Т1–Т2 (n=83):
- низкий онкологический риск (ПСА ≤10 нг/мл, Глиссон ≤ 6) — 21;
- средний онкологический риск (ПСА 10–20 нг/мл, Глиссон 6–7) — 43;
- высокий онкологический риск (ПСА >20 нг/мл, Глиссон ≥8) — 19 (из них 7 больным проводилась нео- и/или адьювантная гормональная терапия).
- Местнораспространённый процесс (n=43):
- Т3а — 31 (из них 4 больным не проводилась нео- и/или адьювантная гормональная терапия);
- Т3b — 10;
- Т4 — 2.
- Диссеминированный процесс (N+М+) (n=15).
У пациентов с местнораспространенным процессом, HIFU терапия несёт паллиативный характер, поэтому в нашей работе были проанализированы результаты лечения 114 больных, из которых у 83 был диагностирован локализованный рак, у 31 HIFU-терапия выполнялась при местнораспространённом раке. Из 114 пациентов 34 (7 с высоким онкологическим риском и 27 со стадией заболевания Т3а) проводилась гормональная терапия.
Показаниями для проведения сеанса HIFU являлись: рак предстательной железы локализованных стадий у пациентов с невозможностью или нежеланием пациентов выполнения радикальной простатэктомии, местнораспространённый и распространённый процессы в сочетании с гормональной терапией в виде адьювантной местной терапии, местный рецидив рака простаты (после сеанса HIFU, радикальной простатэктомии, лучевой терапии).
Абсолютными противопоказаниями были: отсутствие прямой кишки, утолщение стенки прямой кишки более 8 мм, уменьшение объёма ампулы прямой кишки менее 50 см 3 . Относительные противопоказания: объём простаты более 60 см 3 , наличие гиперэхогенных образований с акустической дорожкой. Объём предстательной железы до лечения составлял от 8 до 62,3 см 3 , в среднем 25,4 см 3 . Средний возраст пациентов составил 66,3±5,83 года (от 46 лет до 81 года) (рисунок 2).

Рис. 2. Распределение пациентов, получавших HIFU-терапию, по возрасту
Используемые методы исследования:
- сбор жалоб и анамнеза;
- пальцевое ректальное исследование;
- определение концентрации простатоспецифического антигена;
- трансректальное ультразвуковое исследование;
- цветовое допплеровское картирование;
- магнитно-резонансная томография органов малого таза;
- биопсия предстательной железы;
- другие методы исследования (радионуклидное сканирование костей скелета, рутинное лабораторное обследование, урофлоуметрия).
Используемые методы лечения:
- трансуретральная резекция предстательной железы;
- высокоинтенсивный фокусированный ультразвук.
Для статистической обработки данных использовалась программы Excel и SPSS версия 16.0.
В работе использовались следующие общеупотребимые статистические методики: в описательной статистике рассчитывались минимальные и максимальные значения, средние арифметические значения, средние квадратические отклонения, средние квадратические (стандартные) ошибки средних значений, относительные величины частоты и распределения; при распределении, отличающемся от нормального, рассчитывали медиану и интерквартильный размах; для сравнения признаков с нормальным распределением использовался ANOVA тест (дисперсионный анализ); при сравнении признаков с распределением, отличным от нормального, использовали непараметрические критерии — метод U Манна–Уитни, а также метод Колмогорова–Смирнова; для оценки корреляции (взаимосвязи) нескольких признаков проводили корреляционный анализ по Спирмену и/или Пирсону.
Различия считались статистически достоверными при значении р менее 0,05.
Результаты исследования
Традиционные методы мониторинга в ранней диагностике рецидива РПЖ после HIFU-терапии
Средний уровень ПСА перед сеансом HIFU отличался в зависимости от проведения гормональной терапии: у пациентов без неё составлял до сеанса HIFU 6,9 нг/мл, у больных, получавших гормональную терапию, — 5,5 нг/мл.
Концентрацию ПСА в крови измеряли всем пациентам через каждые 1,5 месяца в течение 6 месяцев после операции, в дальнейшем — через каждые 3 месяца до года и далее через 6 месяцев.
Медиана nadir ПСА составляла 0,5 нг/мл к 3 месяцам после лечения (рисунки 3 и 4).

Рис. 3. Динамика уровня ПСА после HIFU-терапии пациентов с РПЖ, не получавших ГТ (n=80).

Рис. 4. Динамика уровня ПСА после HIFU-терапии пациентов с РПЖ, получавших ГТ (n=34).
У пациентов различались показатели динамики ПСА в зависимости от онкологического риска, стадии и проведения гормональной терапии (табл. 1).
У пациентов с низким онкологическим риском была изначально более низкая концентрация ПСА, в дальнейшем концентрация ПСА быстрее достигала уровня nadir. У пациентов с распространёнными формами рака простаты прослеживалась чёткая зависимость концентрации ПСА от распространённости процесса. Время достижения nadir ПСА существенно не отличалось, составляя в среднем 12–14 недель. У пациентов, получавших гормональную терапию, достигались более низкие значения nadir ПСА. Нами были оценены диагностические возможности традиционных методов мониторинга эффективности HIFU-терапии (таблицы 2, 3 и 4). Определение уровня ПСА значительно превосходило пальцевое ректальное исследование по чувствительности и специфичности. ТРУЗИ было сопоставимо с определением уровня ПСА по специфичности, но также значительно уступало по чувствительности.
Таким образом, мониторинг концентрации ПСА представляет собой основной метод оценки эффективности HIFU терапии, который обладает весьма высокой чувствительностью. Однако недостаточная специфичность обуславливает гипердиагностику, которая может вести к избыточному обследованию многих пациентов, в том числе с использованием высокотехнологичных, дорогих и инвазивных диагностических методов.
У всех больных в первые дни после HIFU отмечалось увеличение простаты в среднем на 75% от первоначального объема. Затем с 10-го дня намечалась тенденция к уменьшению. В дальнейшем размеры простаты постепенно уменьшались, и к 6 месяцам оставалось, в среднем, около 10 см 3 железы (таблица 5).
Нами была проанализирована взаимосвязь объёма предстательной железы до и после HIFU-терапии и значения nadir ПСА у пациентов, не получавших гормональную терапию, у которых получен негативный результат контрольной биопсии. Отмечено, что наименьшее значение nadir — 0,15, получено у пациентов с исходным объёмом железы до 30 см 3 (таблица 6).
Информативность цветового допплеровского картирования в мониторинге больных после HIFU-терапии
Цветовое доплеровское картирование
Контрольное цветовое допплеровское картирование проводилось пациентам после HIFU совместно с ТРУЗИ:
- на следующий день;
- через 7–10 дней;
- через 1,5 мес;
- через 3 мес;
- через 5–6 мес;
- через 1 год.
Теоретической предпосылкой для использования ЦДК в диагностике является тот факт, что кровоток в простате характеризует живую ткань. Предполагая, что живая ткань в простате после HIFU терапии с высокой степенью вероятности является злокачественной, целесообразным видится выполнение прицельной биопсии из подозрительных (с кровотоком участков).
Впервые дни (на следующий день и через 7 дней после операции) кровоток не определялся почти у всех больных. Наиболее вероятным представляется связь этого с отеком тканей. Значение этого фактора подтверждается увеличением простаты в объёме в среднем на 75% от исходного. Уменьшение объёма простаты происходило в среднем с 10-го дня послеоперационного периода и продолжалось в течение 4-6 месяцев. Таким образом, достоверно говорить о подозрении на рецидив рака простаты при использовании цветового допплеровского картирования возможно не раньше, чем через 1,5–4 месяца после операции.
Магнитно-резонансная томография органов малого таза у больных раком предстательной железы после HIFU-терапии
Для оценки эффективности МРТ в мониторинге после HIFU терапии в рамках данного исследования магнитно-резонансная томография выполнялась после HIFU-терапии у 33 пациентов. Из них у 10 пациентов, составивших группу контроля, стандартные методы диагностики не обнаруживали признаков, подозрительных на рецидив опухоли, а у 23 больных имелись признаки, подозрительные на рецидив.
Для уточнения информативности МРТ в двух этих группах нами был проведен подгрупповой анализ (таблица 7).
МРТ в диагностике рецидива опухоли после HIFU терапии имеет умеренную чувствительность (53,3%) и умеренную специфичность (80,5%), что означает для клинической практики следующее: при обнаружении на МРТ признаков рецидива рака, наличие данного заболевания требует уточнения при помощи биопсии. Отрицательный результат не позволяет исключить отсутствия раковых клеток. МРТ имеет несколько большую чувствительность и специфичность относительно ЦДК у больных, получавших гормональную терапию, и почти такая же чувствительность по сравнению с ЦДК у больных, не получавших гормональной терапии.
Заключение
Нами разработан алгоритм наблюдения после лечения HIFU, который представлен на рисунке 5.

Рис. 5. Алгоритм обследования больных локализованным раком простаты после HIFU-терапии.
Через 3–4,5 месяца после HIFU-терапии больному необходимо определять уровень ПСА, выполнять пальцевое ректальное исследование, ТРУЗИ и цветовое допплеровское УЗИ. В случае роста уровня ПСА, nadir ПСА выше 0,5 нг/мл, наличия кровотока при ЦДК, показано выполнение прицельной полифокальной биопсии предстательной железы.
У больных, получающих гормональную терапию, для определения эффективности лечения контрольная биопсия целесообразна в любом случае. В таблице 8 приведены сводные данные по чувствительности и специфичности всех методов мониторинга, применявшихся в нашем исследовании. Необходимо отметить, что МРТ выполнена 33 пациентам из 114.
Полученные данные зависят от проведения гормональной терапии. Наибольшими чувствительностью и специфичностью обладают определение уровня ПСА, эходопплерография и МРТ.
Выводы:
- Традиционные методы мониторинга (пальцевое ректальное исследование, трансректальное ультразвуковое исследование) имеют низкие показатели чувствительности и специфичности (6,1% и 47,1% для ПРИ, 9,2% и 52,7% для ТРУЗИ, соответственно) в диагностике рецидива рака предстательной железы после HIFU-терапии простаты.
- Мониторинг концентрации ПСА (nadir ПСА к 3 месяцам, динамика изменения концентрации ПСА) имеет большое значение в раннем выявлении рецидива после HIFU-терапии простаты. Высокий уровень nadir ПСА и рост ПСА с течением времени — важные прогностические факторы.
- Положительные результаты цветового допплеровского картирования у пациентов, которым не проводилась гормональная терапия, в 3,2 раза повышают вероятность обнаружения рака при биопсии у больных, перенесших лечение высокоинтенсивным фокусированным ультразвуком. У пациентов, которым проводилась гормональная терапия, результаты ЦДК не повышают вероятность обнаружения рака.
- Магнитно-резонансная томография не имеет серьёзных преимуществ по сравнению с цветовым допплеровским картированием в выявлении местного рецидива после HIFU терапии у пациентов, не получавших гормональную терапию.
- Применение МРТ целесообразно для оценки распространённости опухолевого процесса и у больных с сопутствующей гормональной терапией, если данные МРТ могут влиять на дальнейшую тактику лечения.
- Использование цветового допплеровского картирования, пальцевого ректального исследования, трансректального ультразвукового исследования, определение концентрации ПСА в ранние сроки после операции (до 3 месяцев) нецелесообразно в связи невозможностью интерпретации получаемых данных.
Литература
- Trackless surgery using focused ultrasound: Technique and case report / G.R. Haar, R.L. Clarke, M.G. Vaughan, C.R. Hill // Minimal Invasive Ther. – 2011. – № 1. Р. 13-15.
- Histological changes in rat liver tumours treated with high-intensity focused ultrasound / L. Chen, I. Rivens, G.R. Haar et al. // Ultrasound Med. Biol. – 2010 – Vol. 19. – 67-74.
- In vivo effects of high-intensity ultrasound on prostatic adenocarcinoma Dunning R3327 / J.Y. Chapelon, J. Margonari, F. Vernier et al. // Cancer Res. 2012. – Vol. 52. – P. 6353-6357.
- Influence of high-intensity focused ultrasound on the development of metastases / G.O.N. Oosierhof, E.В. Cornel, G.A.H.J. Smits et al. // Eur. Urol. – 2011. – Vol. 32. – P. 91—95.
- Effect of high-intensity focused ultrasound on human prostate cancer in vivo / S. Madersbacher, M. Pedevilla, L. lingers et al. // Cancer Res. – 2011. – Vol.55 (15). – P. 3346 – 3351.
- High-intensity focused ultrasound and localized prostate cancer: Efficacy results from the European Multicentric study / S. Thuroff, C. Chaussy, G.Vallancien et al. // J. Endourol. 2012. – Vol. 17. – Р. 673-677.
- High-intensity focused ultrasound for the treatment of localized prostate cancer: 5-year experience / A. Blana, В. Walter, S. Rogenhofer, W.F. Wieland // Urology. – 2010. – Vol. 63 (2). – Р. 297—300.
- Transrectal high intensity focused ultrasound for the treatment of localized prostate cancer: Factors influencing the outcome / A. Gelet, J.Y. Chapelon, R. Bouvier et al. // Eur. Urol. -2011. – Vol. 40. – Р. 124-129.
- Results of transrectal focused ultrasound for the treatment of localized prostate cancer (120 patients with PSA < or + 10 ng/ml / L. Poissonnier, A. Gelet, J.Y. Chapelon et al. // Progr. Urol. – 2011. - Vol. 13 (1). – Р. 60-72.
Таблицы
Таблица 1. Динамика уровня ПСА в зависимости от стадии заболевания и нео и/или адьювантной гормональной терапии
Лучевая терапия при раке простаты

Лучевая терапия рака простаты – альтернатива радикальной простатэктомии. Цель облучения заключается в уничтожении опухолевых клеток. Наиболее часто проводится лучевая терапия с использованием современных линейных ускорителей. Злокачественную опухоль лечат с разных направлений и в несколько сеансов. Это позволяет уменьшить побочные эффекты.
Лечение рака предстательной железы лучевой терапией тормозит деление раковых клеток, останавливая рост опухоли. Эффект лучевой терапии наступает спустя некоторое время. Радиотерапия значительно уменьшает, а также полностью устраняет раковые клетки, позволяя контролировать рак предстательной железы. Но и спустя годы возможны рецидивы. Результативно ли проведенное лечение, можно сказать только через 15 лет.
О лучевой терапии при раке простаты
Когда назначается лучевая терапия при раке простаты
При выборе подходящей терапии решающую роль играет возраст пациента, сопутствующие заболевания и опухолевая стадия: ранний рак предстательной железы, локально ограниченный. Облучение является одним из способов остановить рост опухоли и, по возможности, улучшить состояние.
Прежде чем принимать решение об облучении, врач рассматривает альтернативы:
При локально прогрессирующем раке предстательной железы даже при метастазировании из облучения может быть извлечена выгода. В дополнение к облучению назначается антигормональная терапия.
После радикальной простатэктомии адъювантная лучевая терапия имеет смысл. Цель: предотвратить прогрессирование заболевания, а также образование метастазов. Перед облучением нужно взвесить все за и против, т. е. определить, превышает ли польза терапии возможные побочные эффекты.
Показания к проведению радиотерапии при раке предстательной железы:
нераспространенная опухоль в сочетании с гормональной терапией и операцией;
наличие остаточной опухолевой ткани после хирургического вмешательства;
прогрессирующий рак предстательной железы с метастазами (для облегчения симптомов болезни).
Существует также возможность с помощью радиотерапии целенаправленно уничтожать метастазы, которые распространились в печень или легкие. Но этот подход считается экспериментальным и проводится в рамках клинических испытаний. Пациентам лекарства обычно помогают больше – потому что антигормональная терапия и химиотерапия действуют не избирательно, а по всему телу.


Виды лучевой терапии при раке простаты
Для лечения рака предстательной железы доступны следующие методы протонной лучевой терапии:
Чрескожная радиотерапия (дистанционная): «классическая» лучевая терапия, которая проводится на всех стадиях заболевания. Сочетается с дальнейшими методами лечения в зависимости от ситуации.
Брахитерапия (чрескожное облучение): радиоактивный источник вводится непосредственно в предстательную железу. Назначается только при отсутствии метастазов. Эффективность брахитерапии зависит от индивидуального риска рецидива.
Чрескожное облучение имеет наибольший опыт в терапии рака предстательной железы. Предыдущие данные показывают: шансы на выздоровление при локально ограниченном и локально продвинутом раке аналогичны шансам операции (радикальной простатэктомии). При необходимости назначается дополнительная адъювантная гормональная терапия.
Подготовка наружной лучевой терапии, в отличие от самого лечения, относительно трудоемка: доза облучения и лучевое поле рассчитываются с помощью компьютера. Это гарантирует, что облучаться будет только опухоль, а здоровые ткани останутся максимально сохраненными.
Брахитерапия назначается пациентам, у которых опухоль не выходит за пределы предстательной железы. Мужчины, которые предварительно прооперированы из-за доброкачественного заболевания предстательной железы или по другим причинам, обычно не могут лечиться с помощью внутренних радиоактивных источников.
Процедура лучевой терапии при раке простаты
Чрескожная лучевая терапия при раке простаты проводится амбулаторно. Пациент может вернуться домой после сеанса облучения. Лечение длится 7-9 недель. У большинства пострадавших в этот период процедуры проводятся каждый день, за исключением выходных дней. От этого графика возможны отклонения.
Ход процедуры радиотерапии при раке простаты:
Пациент занимает место на кушетке под так называемым линейным ускорителем.
Устройство вращается, воздействуя на опухоль с разных направлений.
Дискомфорт во время процедуры отсутствует.
Один сеанс облучения длится от нескольких секунд до нескольких минут.
Доза облучения распределяется равномерно в течение всего периода лечения, при этом говорят о «фракционировании». Общие показатели терапии составляют 74-80 Гр (одна процедура от 1,8 до 2,0 Гр). Доза рассчитывается в зависимости от стадии опухоли, а также от того, как врачи оценивают риск рецидива.
Современные методы облучения воздействуют преимущественно на опухоль, не повреждая здоровую ткань: интенсивно-модулированная радиотерапия (IMRT) – чрескожное облучение с компьютерным планированием. Объединяет компьютер и облучающее устройство.
Брахитерапия при раке простаты также проводится в амбулаторных условиях:
Пациенту вводится наркоз и устанавливается катетер мочевого пузыря.
Через катетер поступает контрастное вещество в мочевой пузырь для улучшения визуализации при проведении УЗИ. Это гарантирует, что при имплантации радиоактивных источников не возникнет травм.
С помощью полых игл вводятся источники радиации, заполненные радиоактивными частицами металла размером всего в несколько миллиметров. Эти «семена» остаются в предстательной железе.
В качестве источника излучения обычно используется йод-125 или палладий-103. Оба «излучателя» радиоактивны, но имеют короткий период полураспада и диапазон от нескольких миллиметров до сантиметров. Излучение в основном ограничивается опухолью и длится всего несколько недель.
Лучевая терапия при метастазах
Классическое облучение облегчает боль у пациентов с метастазами в кости, а также улучшает стабильность костных структур. Это актуально, если гормональная терапия не дает достаточного эффекта или есть выраженный дискомфорт. Радиотерапия для лечения метастазов при раке простаты не используется, т. к. является не эффективной.


Сочетание лучевой терапии с другими видами лечения
Обычно врачи рекомендуют удалить простату при злокачественном поражении. На 1-2 стадии прогрессирования возможно облучение. Но на 3-4 стадии без операции не обойтись. Радиотерапия в этом случае возможна только при наличии противопоказаний к хирургическому вмешательству.
Лучевая терапия используется до проведения простатэктомии и после операции. Облучение помогает уменьшить размеры злокачественного образования и «добить» поврежденные клетки, которые не были удалены хирургическим путем. Радиотерапия проводится через несколько недель после простатэктомии, что дает возможность тканям восстановиться.
Одно преимущество облучения сразу очевидно: мужчинам не нужно проходить операцию. Хирургическое вмешательство всегда связано с рисками и побочными эффектами, такими как:
кровотечение или присоединение инфекции;
недержание мочи или импотенция;
эректильная дисфункция, связанная с повреждением нервов;
накопление воды в тканях (лимфедема).
Кроме того, мужчины становятся недееспособными после удаления предстательной железы. Это важный аргумент, особенно для тех, кто планирует семью.
Недостатком является то, что для лучевой терапии при раке предстательной железы требуется терпение. В отличие от операции, лечение не выполняется в течение нескольких дней. Нужно ездить в клинику для облучения 5 раз в неделю в течение 6-9 недель.
Рак предстательной железы у большинства больных является гормонозависимым: тестостерон (мужской половой гормон) способствует росту опухоли. В этом случае лучевая терапия сочетается с гормональной: выработка тестостерона медикаментозно подавляется или его действие замедляется, что способствует остановке роста опухоли.
Побочные реакции лучевой терапии при раке простаты
Во время или после облучения рака предстательной железы могут возникать различные побочные эффекты. У большинства пациентов проходит около 3-4 недель до появления выраженного дискомфорта. Нежелательные последствия прекращаются, как правило, после окончания лучевой терапии.
Дискомфорт зависит от дозы облучения и размера лучевого поля – чем целенаправленнее облучение, тем менее вероятны побочные эффекты.
Основные побочные эффекты лечения рака простаты лучевой терапией:
Раздражение кожи в области облучения. Возможно покраснение, зуд или незначительная боль. Более серьезное повреждение кожи встречается редко. Нужно использовать pH-нейтральные средства для личной гигиены и носить свободную одежду.
Воспаление слизистых оболочек в мочевом пузыре и уретре. Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.
Воспаление слизистой оболочки в кишечнике. Дефекация может быть временно болезненной, также возможны легкие кровотечения или диарея. Для устранения воспаления назначаются суппозитории кортизона и при необходимости средства от повышенной активности кишечника.
При интенсивно-модулированной лучевой терапии (IMRT) острый дискомфорт после терапии меньше, чем при «классическом» облучении, т. к. мочевой пузырь и кишечник практически не подвергается воздействию лучей.
Возникают также долгосрочные последствия облучения, которые зависят не только от дозы облучения, но и от индивидуальных факторов. Если побочные реакции появляются спустя длительный промежуток времени после окончания лечения, то назначается интенсивный последующий уход. К долгосрочным последствиям относится также склонность к диарее, изменения кишечника, мочевого пузыря и уретры, а также недержание мочи.
В 50% случаев лечения рака предстательной железы мужчины сталкиваются с эректильной дисфункцией. Эта проблема решается с помощью соответствующих медикаментов, которые должен назначить врач. После обычной чрескожной лучевой терапии уже не все мужчины способны зачать детей. Пациенты, у которых все еще есть желание иметь ребенка, должны сделать клиническую процедуру замораживания спермы до начала лечения. На поддержание фертильности ни в коем случае не следует полагаться, даже после брахитерапии.
Любое радиационное воздействие повышает риск развития злокачественных новообразований. У мужчин с онкологией предстательной железы есть вероятность развития рака прямой кишки и, возможно, других тканей, находящихся в лучевом поле. Риск вторичных опухолей увеличивается спустя 10 лет. Через 5-8 лет повышается вероятность развития рака мочевого пузыря на 50%, рака прямой кишки на 70%.
Метастазы при раке предстательной железы
Рак предстательной железы прогрессирует медленно. На ранних стадиях заболевание не имеет ярких симптомов, которые могли бы стать стимулом для обращения к врачу, анализа на ПСА (простатспецифический антиген) или комплексного обследования. Само по себе это уже фактор риска.
В России и странах СНГ до сих пор велика доля диагнозов, поставленных на поздних стадиях, когда опухоль уже дала метастазы в лимфоузлы и другие органы. В США на долю рака простаты с метастазами приходится только 5 % впервые поставленных диагнозов . Благодаря широкому внедрению скрининга ПСА среди мужчин в возрасте от 50 лет (и старше 40 лет при неблагоприятном семейном анамнезе) количество случаев рака простаты, обнаруженного «слишком поздно», удалось сократить на 45 %.
Что происходит, когда если диагноз не был поставлен вовремя и опухоль осталась без лечения? В благоприятных условиях начинается процесс метастазирования – опухоль прогрессирует, постепенно распространяется на здоровые ткани и формирует вторичные очаги.
Что такое метастазы рака простаты
Метастазы (от др.-греч. «перемещение») — отдалённые вторичные очаги злокачественной опухоли, сформировавшийся при перемещении опухолевых клеток из первичного очага в тканях простаты. О начале процесса метастазирования можно говорить, когда опухоль выходит за пределы капсулы простаты.
Наиболее распространенный тип злокачественной опухоли простаты – ацинарная аденокарцинома. На ее долю приходится 80 – 90 % всех выявленных случаев. В первую очередь, она распространяется на семенные пузырьки и в тазовые лимфоузлы, а затем на здоровые ткани ближайших органов (шейка мочевого пузыря, кишечник). Наибольшему риску поражения отдалёнными метастазами при аденокарциноме простаты подвержены кости осевого скелета.
Откуда берутся отдалённые метастазы? В норме, способностью к миграции обладают только стволовые клетки и лейкоциты. Атипичные низкодифференцированные клетки аденокарциномы становятся похожими на стволовые по ряду признаков. Межклеточные связи в первичном очаге опухоли слабеют – это создает условия для отделения и миграции злокачественных клеток.
Основные пути разрастания метастазов
- По кровеносным сосудам (гематогенный путь)
- По лимфатическим сосудам (лимфогенный путь)
Наиболее уязвимы печень, лёгкие, головной мозг, костный мозг, кости осевого скелета.
Основные органы-мишени – тазовые и забрюшинные лимфатические узлы, подвздошные лимфоузлы, реже органы ЦНС.
Оценка риска метастатического поражения лимфоузлов
| Группа риска | Стадия РПЖ | ПСА, нг/мл | Сумма баллов по шкале Глисона | Вероятность метастазирования в лимфоузлы | Выживаемость без рецидивов в течение 10 лет |
|---|---|---|---|---|---|
| Низкий. Все факторы | T1 – T2a | < 10 | 2 – 6 | < 5 % | 70 – 90 % |
| Промежуточный. один из факторов | T2b – T2c | 10 – 20 | 7 | 5 – 15 % | 60 – 75 % |
| Высокий один из факторов | T3a | > 20 | 8 – 10 | 16 – 49 % | 43 – 60 % |
Симптомы, которые должны вызвать настороженность
- Непроходимость мочевых путей, затрудненное мочеиспускание указывают на сдавление шейки мочевого пузыря из-за большого объёма или прорастания опухоли;
- Примесь крови в моче, эпизоды недержания мочи появляются, когда опухоль прорастает в шейку мочевого пузыря;
- Эректильная дисфункция может указывать на то, что опухоль затронула сосудисто-нервные пучки;
- Дискомфорт при сидении и боли в промежности ощущаются, когда задеты мышцы тазового дна;
- Отёки ног или паховой области, лимфостаз – признаки поражения тазовых лимфатических узлов.
Заметив один или несколько из этих симптомов, следует срочно обратиться к врачу.
Рак простаты с метастазами в ближайших органах (местно-распространённый) достаточно хорошо поддается комплексному лечению. Методы первого выбора – радикальная робот-ассистированная простатэктомия с удалением семенных пузырьков и тазовых лимфоузлов (лимфаденэктомией) или дистанционная лучевая терапия. Операция снижает риск рецидива опухоли и появления метастазов в дальнейшем. Для усиления эффекта пациентам, которые относятся к группе промежуточного и высокого риска, дополнительно назначается курс лучевой терапии или гормональное лечение.
Отдалённые метастазы: куда метастазирует рак простаты
Кости осевого скелета
Особенности строения венозно-вертебрального сплетения, в которое поступает кровь из полости таза, делают костную систему человека наиболее уязвимой при миграции злокачественных клеток из первичного очага опухоли в простате. С током крови атипичные клетки беспрепятственно достигают сосудов костного мозга и костей осевого скелета. Метастазы РПЖ часто выявляются в позвоночнике, костях таза, рёбрах и др. Типичные симптомы метастазов в костях при раке простаты – боль, которую не удается снять анальгетиками, аномально долго заживающие переломы, деформация пораженной кости.
Печень
Злокачественные клетки попадают в печень преимущественно по кровеносным сосудам. Вторичные очаги опухоли могут долго развиваться без симптомов. При значительном поражении наблюдаются слабость, снижение аппетита, тупая боль в правом боку, давящая боль в области желудка.
Лёгкие
Лёгкие – один из самых уязвимых органов для гематогенного метастазирования. Как и при поражении других органов, метастазы развиваются без явной симптоматики. На поздних стадиях возможно появление хронического кашля, одышки, ощущение «тяжести» в груди.
Органы ЦНС
Злокачественные клетки могут достигать органов ЦНС как с кровью, так и с лимфой. Наиболее ранним из симптомов метастатического процесса обычно становятся интенсивные головные боли, иногда они могут сопровождаться тошнотой и головокружением.
Лечение рака простаты с метастазами часто осложняется тем, что злокачественные клетки образуют вторичные очаги опухоли сразу в нескольких органах. До 95 % пациентов, у которых диагностируются метастазы в мозге, имеют метастатические поражения костей. Мозг, кости и лёгкие затрагиваются в 31 % случаев; мозг, кости лёгкие и печень – в 19 % случаев.
Методы диагностики и оценки распространённости рака предстательной железы
УЗИ малого таза / ТРУЗИ
Это базовые исследования, благодаря которым врач может оценить объём простаты, состояние семенных пузырьков, рассмотреть лимфоузлы таза и забрюшинного пространства, печени и т.д. Методы ультразвуковой диагностики позволяют с достаточно точно визуализировать саму простату, но не дают возможности судить о злокачественности опухоли и с высокой достоверностью выявлять метастазы размером меньше 5 мм. Как уточняющее исследование рекомендуется МРТ.
Онкомаркеры
ПСА – простат-специфический антиген, повышение концентрации ПСА коррелирует с ДГПЖ и раком простаты (в норме концентрация ПСА в сыворотке крови здорового человека составляет 2,5 – 4 нг/мл);
Тканевый полипептидный специфический антиген (TRS) – при наличии метастазов концентрация TRS повышается в 3 раза;
Антиген стволовых клеток предстательной железы (PSCA) – повышенная концентрация PSCA выявляется при злокачественных опухолях простаты и коррелирует с поздними стадиями заболевания.
Трансректальная биопсия под контролем УЗИ
Биопсия и гистологическая диагностика опухоли – единственный способ подтвердить диагноз РПЖ и определить степень злокачественности новообразования. Чтобы получить достаточное количество ткани для гистологии и оценки по шкале Глисона из простаты под контролем УЗИ отбираются 6 -12 образцов.
МРТ
Уточняющий метод исследования, позволяющий получить серию поперечных и продольных срезов предстательной железы и окружающих тканей. Как правило, оценка местной распространенности опухоли производится врачом именно на основании МРТ. Исследование позволяет с высокой достоверностью определить, вышла ли опухоль за пределы капсулы простаты, затронуты ли органы, расположенные рядом, в каком состоянии находятся лимфоузлы таза (их увеличение может быть признаком начала метастатического процесса).
КТ
Компьютерная томография используется для оценки состояния лимфоузлов таза и определения полей облучения при лучевой терапии.
ПЭТ с холином
Метод применяется для выявления отдалённых метастазов при высоких уровнях ПСА, а также для оценки состояния лимфоузлов в спорных случаях, когда необходимо отличить воспалительные изменения в лимфоузле от метастазов опухоли.
Тазовая лимфаденэктомия
Наиболее точный метод оценки состояния регионарных лимфоузлов при РПЖ, позволяющий выявлять метастазы размером менее 5 мм.
Остеосцинтиграфия
Наиболее информативный метод выявления метастазов в костях. Радиоизотопное сканирование костей может быть рекомендовано всем пациентам с дифференцировкой опухоли по Глисону ≥ 8 или ПСА превышающим 10.
Рентгенография или КТ органов грудной клетки
Выполняется для проверки лёгких на наличие метастазов.
КТ живота и таза
Исследование назначается при подозрении на висцеральные метастазы. В некоторых случаях для выявления отдалённых метастазов может быть рекомендовано МРТ или ПЭТ-КТ всего тела.
Лечение распространенного рака предстательной железы
Большинство пациентов выбирают радикальные методы лечения в ситуациях, когда рак потенциально излечим, а операция дает надежду на сохранение привычного качества жизни. Если речь идет об опухоли, которая уже вышла за пределы капсулы простаты, радикальная простатэктомия может быть выполнена как один из этапов комплексного (мультимодального) лечения. Хирурги Европейского Центра Простаты в Гронау придерживаются этой тактики во всех случаях, когда состояние здоровья пациента позволяет провести операцию и продлить продолжительность жизни.
Радикальная простатэктомия + лимфаденэктомия
При наличии онкологического процесса, распространившегося на окружающие простату органы, пациентам, относящимся к группе высокого риска (стадия ≥T3a, сумма по шкале Глисона 8-10, ПСА >20 нг/мл), может быть предложена робот-ассистированная радикальная простатэктомия (РПЭ) совмещенная с лимфаденэктомией (удалением пораженных лимфатических узлов). В Европейском Центре Простаты в Гронау обе операции выполняются одновременно с применением роботизированной системы Да Винчи.
Особенности операции на стадии T3a:
- Отказ от нервосберегающей техники, удаление сосудисто-нервных пучков (сохранение потенции на этой стадии – не приоритетная цель при выполнении операции);
- Обширное удаление тканей за пределами капсулы железы, которые затронула опухоль;
- Удаление лимфоузлов – наружных, обтураторных, внутренних и общих подвздошных.
Даже при увеличенном объёме вмешательства точность робот-ассистированной простатэктомии Да Винчи позволяет свести к минимуму травмы проксимального отдела и сфинктера уретры, а также шейки мочевого пузыря. Для пациента это означает, что процесс реабилитации будет легче, а естественная функция удержания мочи восстановится быстрее.
Лучевая терапия
Показаниями к лучевой терапии после операции РПЭ считаются:
- Позитивный хирургический край;
- Стадия заболевания T3a -T3b;
- Сумма по Глисону 8 – 10 баллов.
В качестве альтернативы на стадии T3a – T4N0M0 пациентам с ожидаемой продолжительностью жизни более 10 лет может быть рекомендована конформная лучевая терапия с эскалацией дозы излучения по методике IMRT (эффективная доза ≥70 Гр).
Как и радикальная простатэктомия, лучевая терапия применяется в качестве одного из компонентов комбинированного лечения. Вариант совмещения лучевой и гормональной терапии считается более эффективным, чем каждая из них по отдельности. Комбинированное лечение достоверно улучшает качество и продолжительность жизни на третьей и четвертой стадиях простаты при наличии метастазов.
Паллиативная лучевая терапия при метастазах в кости
Метод применяется для обезболивания. При одиночных (солитарных) метастазах облучение направляется на пораженную зону, в которой локализован болевой синдром. При множественном поражении костей практикуется применение радионуклидов стронция-89 и самария-153.
Гормональная терапия
Для пациентов со стадией заболевания T3a гормональная терапия служит дополнением радикального лечения (хирургического или лучевого). Но в ситуациях, когда рак простаты уже дал отдалённые метастазы, это метод первого выбора.
Когда оправдано назначение самостоятельной гормональной терапии:
- Выраженные симптомы рака простаты;
- Стадия заболевания Т3-Т4;
- ПСА >25 нг/мл;
- Отдалённые метастазы.
Блокада андрогенов, которые стимулируют рост опухолевых клеток, замедляет рост опухоли и снижает риск болезненных осложнений из-за распространения метастазов. Онколог индивидуально подбирает режим терапии (постоянный или прерывистый), исходя из стадии заболевания, течения болезни, скорости прироста ПСА, риска прогрессии и других факторов.
Химиотерапия
Метод применяется, когда рак с метастазами не отвечает на гормональное лечение. При метастазах в кости наряду с противораковыми препаратами (доцетаксел и др.) используются бисфосфонаты, моноклональные антитела IgG2 и препараты кальция для снижения риска осложнений. При выраженном болевом синдроме назначается паллиативная лучевая терапия.
На сегодняшний день Хирурги Европейского Центра Простаты в Гронау выполнили более 13 000 робот-ассистированных операций по удалению опухолей простаты и пораженных лимфоузлов. Это уникальный опыт в масштабах Европы. Мы добиваемся хороших функциональных результатов, работая с пациентами с 3 стадией рака простаты, с установленными стентами, водителями ритма, в возрасте старше 65 лет – словом, с теми, кому по каким-то причинам не смогли помочь в других клиниках. Проконсультируйтесь с онкологом Центра, чтобы узнать о перспективах хирургического лечения в вашем случае.


