Новое поколение противораковых препаратов
На ежегодной 43–й конференции Американского Общества клинической онкологии (ASCO) в Чикаго компания Рош представила самые последние результаты клинических исследований противоопухолевых препаратов, позволяющих значительно продлевать, а иногда даже спасать жизнь онкологических пациентов. Речь идет об инновационных препаратах, относящихся к так называемой «таргетной группе» (от англ. target — цель, мишень). Их действие направлено против определенных биологических мишеней, которые способствуют росту злокачественных клеток, тканей, опухолей. Важно то, что они точечно воздействуют на злокачественные клетки, не оказывая вредного воздействия на организм.
Над разработкой точечных методов лечения ученые трудились не одно десятилетие. К внедрению таргетной терапии специалисты шли почти полвека. Еще в 60—70–х годах прошлого века американский ученый Фолкман предположил, что гораздо эффективнее бороться не с самой опухолью, а с факторами ее роста – ангиогенезом. Это было предпосылкой для зарождения нового направления таргетной терапии – антиангиогенной терапии. Она дает возможность предотвращать рост сети кровеносных сосудов, питающих злокачественные клетки, и тем cамым блокировать развитие опухоли.
Сегодня препараты таргетной группы имеют более высокую доказанную эффективность по сравнению с традиционной химиотерапией, а также высокую безопасность и способность значительно улучшать качество жизни онкологических пациентов. Такие препараты успешно применяются в лечении онкологических заболеваний при различных локализациях опухолей.
Рак легкого
Ежегодно в России выявляется свыше 63000 больных раком легкого, из них более 53 000 – мужчины. Немелкоклеточный рак легкого (НМРЛ) – наиболее часто встречающаяся форма (более 80% всех случаев заболевания). При этом его основная разновидность – неплоскоклеточный рак легкого обнаруживается примерно у 60% пациентов с НМРЛ.
Результаты исследования антиангиогенного препарата Авастин, в котором приняли участие более 1000 пациентов с неплоскоклеточным НМРЛ, показали, что добавление Авастина к режиму цисплатин/гемцитабин по сравнению с применением только химиотерапии позволяет сократить смертность и остановить развитие заболевания в 20–30% случаев. При этом частота ответа на опухоль возрастает на 70%, а длительность ответа на терапию увеличивается с 4,7 до 6,1 месяцев.
Авастин действует точечно: мишенью препарата является природный белок, который называется фактор роста эндотелия сосудов (VEGF), являющийся ключевым медиатором ангиогенеза. Воздействуя непосредственно на него, Авастин блокирует процесс роста кровеносных сосудов, которые поставляют опухоли питательные вещества и кислород, замедляет рост микрососудов, подавляет прогрессирование процесса метастазирования и снижает внутриопухолевое давление, в результате чего улучшается поступление цитотоксических препаратов в опухоль, что делает ее более уязвимой для химиотерапии.
Christian Manegold, руководитель исследования «AVAiL», профессор медицины университета г. Гейдельберг и медицинского центра университета г. Мангейм (Германия) отмечает: «Рак легкого чрезвычайно плохо поддается лечению. Полученные результаты дарят реальную надежду многим пациентам. Как показало базовое исследование E4599, Авастин – это единственный препарат, появившийся в этом десятилетии, который позволяет продлить жизнь пациентов с распространенным НМРЛ, не получавших предшествующего лечения. Кроме того, исследование AVAiL продемонстрировало, что Авастин также эффективен при его применении в сочетании с различными режимами химиотерапии».
Рак почки
Каждый год в нашей стране регистрируется более 35 тысяч новых случаев рака почки, и более 12 тысяч больных погибают от этого заболевания. По оценкам специалистов, эта цифра будет расти, так как методы лечения рака почки ограничены. Основным является хирургическое удаление части или всей почки, однако этот метод эффективен только на ранних стадиях заболевания. На поздних стадиях лечение, как правило, заключается в сдерживании роста опухоли и облегчении сопутствующих симптомов.
Результаты базового исследования III фазы AVOREN показали, что добавление Авастина к интерферону – стандарту лечения распространенного рака почки, почти вдвое увеличивает медиану выживаемости без прогрессирования заболевания с 5,4 до 10,2 месяцев. Также значительно (на 31,4%) увеличивается частота ответа опухоли. Полученные в ходе исследования данные свидетельствуют об улучшении показателя общей выживаемости, однако анализ этих результатов еще не завершен. Развития новых и неожиданных нежелательных явлений не наблюдалось.
Bernard Escudier, руководитель отдела иммунотерапии и инновационных методов лечения Института Густава–Русси (Париж, Франция) главный исследователь, профессор считает: «Полученные результаты представляются чрезвычайно важными, поскольку уже давно назрела необходимость в создании более эффективных методов лечения этого типа рака, при котором эффективность химиотерапии и лучевой терапии значительно ниже, чем при других онкологических заболеваниях. Авастин является новым эффективным и хорошо переносимым препаратом для борьбы с этим типом рака».
Рак молочной железы
Рак молочной железы (рак груди, РМЖ) сегодня занимает первое место среди всех онкозаболеваний у женщин и является одной из главных причин женской смертности во всем мире. Показатели заболеваемости раком молочной железы за 20 лет выросли на 50% и продолжают угрожающе расти. Кроме того, это заболевание заметно «помолодело» – нередки случаи заболевания тридцатилетних и даже двадцатилетних женщин. В России ежегодно рак молочной железы выявляется у 50 тыс. женщин.
Наиболее агрессивной формой заболевания является HER2–положительный РМЖ, когда на поверхности опухолевых клеток присутствует повышенное количество HER2 белка. Такая форма плохо поддается лечению, а также характеризуется быстрым ростом опухоли и высокой вероятностью рецидивирования .
Результаты исследования NeOAdjuvant Herceptin (NOAH) показали, что при комбинированном применении химиотерапии и препарата Герцептин перед операцией у пациенток с местнораспространенным HER2–положительным раком молочной железы, наиболее агрессивной формой заболевания, отмечается значительное увеличение частоты ответа на терапию (у 43% пациенток), который проявляется в выраженном сокращении объема опухолевой ткани, вплоть до полного ее исчезновения. Кроме того, препарат значительно улучшает качество жизни пациенток с HER2–положительным РМЖ.
Герцептин – это гуманизированное антитело, разработанное с целью связывания с HER2 белком и блокирования его функции. Препарат эффективен как при лечении РМЖ на начальных стадиях, так и при лечении распространенного (метастатического) РМЖ. Эффективен в качестве монотерапии, а также в комбинации со стандартной химиотерапией.
Jean–Jacques Garaud, глава подразделения Global Drug Development фармацевтической компании Рош подчеркивает: «Полученные данные служат еще одним доказательством того, что Герцептин является основой лечения HER2–положительного рака молочной железы. В настоящее время уже доказано, что Герцептин увеличивает показатели выживаемости у пациенток с распространенным HER2–положительным раком молочной железы и что он является препаратом выбора при лечении ранних стадий рака молочной железы, новые данные говорят о том, что применение Герцептина позволяет сократить объем хирургического вмешательства у пациенток с местнораспространенным раком, а это является чрезвычайно важным для женщин, страдающих этой особенно агрессивной формой заболевания».
На сегодняшний день проводятся исследования новых таргетных препаратов для лечения рака молочной железы. Недавно завершилось исследование II фазы, подтвердившее эффективность препарата пертузумаб, который должен значительно улучшить показатели лечения пациенток с HER2–положительным раком молочной железы, получавших ранее другое лечение. Результаты исследования показали, что комбинация препаратов пертузумаб и Герцептина обладает выраженной противоопухолевой активностью, у 20% пациенток отмечается ответ на лечение пертузумабом, а еще у 20% пациенток наблюдается стабилизация заболевания в течение 6 месяцев и более. Результаты особенно важны, так как положительный эффект наблюдается у пациенток с поздними стадиями заболевания, выбор метода лечения которых очень ограничен.
Пертузумаб является первым препаратом из нового класса инновационных препаратов целенаправленного действия, известных как ингибиторы димеризации HER–рецепторов (ИДР). Препарат предотвращает «образование пары» (димеризацию), белка HER2 с другими представителями семейства рецепторов эпидермальных факторов роста (HER1, HER2, HER3, и HER4). Считается, что это взаимодействие играет важную роль в появлении и прогрессировании различных типов рака. Благодаря различиям в механизме действия, комбинация пертузумаб + Герцептин увеличивает активность Герцептина.
Jean–Jacques Garaud, руководитель Global Pharma Development компании Рош резюмирует: «Положительные результаты, полученные в ходе исследования, способствовали принятию решения о развитии клинических исследований III фазы по изучению пертузумаба у больных раком молочной железы. Мы проведем изучение эффективности пертузумаба при метастатической стадии заболевания, а также при ранних стадиях рака молочной железы, до удаления опухоли хирургическим путем».
Колоректальный рак
Колоректальный рак (рак толстой и прямой кишки, КРР) входит в число лидеров в структуре онкологической заболеваемости и смертности. За последние 20 лет в нашей стране рак толстой кишки переместился с 6–го на 3–е место по частоте заболеваемости. При этом заболевание «молодеет». До недавнего времени колоректальным раком страдали в основном лица старше 50–60 лет. Сейчас в группе риска и люди среднего возраста. При этом в России на 100 новых больных колоректальным раком приходится более 70 умерших. Высокая смертность часто вызвана запущенностью опухолевого процесса. По данным статистики, в России при первичном обращении пациентов к врачу III–IV стадии рака диагностируются у 71,4% больных раком ободочной (толстой) кишки и у 62,4% больных раком прямой кишки.
Результаты исследования NO16966 показали, что эффективность схемы терапии XELOX (комбинация Кселоды и оксалиплатина) при колоректальном раке не уступает эффективности схем лечения, которые требуют внутривенного введения препаратов.
Кселода – это единственный препарат, который активируется непосредственно в опухоли, заставляя ее работать на самоуничтожение. У Кселоды есть важное преимущество – это таблетированный препарат. За счет этого терапия становится более гибкой, так как не требует нахождения пациента в стационаре. Кроме того, больные получили возможность избежать негативных последствий длительных внутривенных инфузий, чреватых риском развития у таких ослабленных больных различных осложнений и тяжелых инфекций, иногда угрожающих жизни.
Вот что говорит Jim Cassidy, руководитель исследования NO 16966, профессор британского исследовательского центра по проблемам рака Cancer Research UK, профессор онкологии Битсоновского онкологического центра при университете в Глазго (Шотландия): «Эти результаты наглядно демонстрируют огромное преимущество XELOX в отношении качества жизни у больных колоректальным раком. Полученные данные говорят, что при лечении распространенного колоректального рака Кселода не менее эффективна, чем химиопрепараты, вводимые внутривенно. Учитывая, что в настоящее время многие виды опухолей можно лечить с помощью пероральных средств, почему мы должны заставлять наших пациентов продолжать инфузионную терапию, делающую положение таких людей еще тяжелее?»
Неходжкинская лимфома
Термином неходжкинские лимфомы обозначают довольно большую группу лимфом, которые не являются лимфогранулематозом (болезнью Ходжкина). Если при микроскопическом исследовании находят специфические для болезни Ходжкина клетки Березовского–Штернберга–Рида, то ставят диагноз болезни Ходжкина. Если эти специфические клетки не находят, то лимфому относят к группе неходжкинских.
По расчетам специалистов, более миллиона человек в мире страдают от неходжкинской лимфомы, при этом смертность составляет 360 000 человек ежегодно, и эта цифра постоянно растет. В России диагностируется около 7 000 тысяч новых случаев заболеваний лимфомами (опухоли лимфатической системы) каждый год. Примерно в 40% случаев болезнь носит агрессивный характер и без лечения приводит к смерти пациента в течение шести месяцев. До сих пор точная причина появления лимфомы не известна. Опухоль может развиться у мужчин, женщин, детей – любого возраста и национальной принадлежности, ведущих самый различный образ жизни. Поэтому совершенствование схем терапии злокачественных опухолей является одним из наиболее важных направлений в онкологии.
Основным методом лечения неходжкинских лимфом считается химиотерапия. Но этот метод ограничен из–за токсичности и, как следствие – плохой переносимости. Радикально улучшить эффективность без повышения токсичности позволило применение таргетного препарата Мабтера, действие которого нацелено непосредственно на опухоль.
Анализ данных 7–летнего наблюдения больных агрессивной неходжкинской лимфомой (НХЛ) показал, что 7–летняя выживаемость пациентов, получавших Мабтеру, составляет 53% по сравнению с 36% у пациентов, получавших только химиотерапию. Это значит, что из 100 больных агрессивной НХЛ еще 17 человек проживут 7 лет благодаря лечению Мабтерой.
Мабтера является терапевтическим антителом, которое специфически связывается с особым белком (антигеном CD20) на поверхности нормальных и злокачественных В–клеток. После связывания антитело мобилизует естественные механизмы защиты для атаки и уничтожения помеченных В–клеток. Антиген CD20 отсутствует на стволовых кроветворных клетках (предшественниках В–клеток) в костном мозге, поэтому здоровые В–клетки восстанавливаются после лечения, и их концентрация достигает нормального уровня в течение нескольких месяцев.
William M. Burns, глава подразделения Фарма компании Рош с оптимизмом смотрит в будущее: «Мабтера все так же эффективно продлевает и восстанавливает жизнь больных агрессивной неходжкинской лимфомой. Спустя семь лет после завершения исследования GELA более половины пациентов, принимавших Мабтеру, живы. Этот пример дарит надежду на выздоровление тысячам других больных».
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Лекарственная терапия
С помощью лекарств сегодня лечат большинство опухолей. Это самый универсальный и самый распространенный метод лечения рака в силу его особенностей:
- простоты введения пациенту (внутривенно или перорально);
- доступа лекарства одномоментно во все клетки и ткани организма;
- возможности на любом этапе корректировать дозу и режим введения препарата или менять лекарство;
- снижения риска выживания злокачественных клеток (клеток рака) в труднодоступных и удаленных местах и возобновления роста опухоли.
Виды лекарственной терапии
С развитием нанотехнологий, молекулярной медицины и генной инженерии в портфеле онкологов появились множество новых противоопухолевых препаратов, лекарства стали более избирательными к злокачественным клеткам и менее токсичными для здоровых тканей и организма в целом. Появились прицельные лекарства, так называемые таргетированные, молекулы которых воздействуют более избирательно на клетки рака.
Все лекарства против рака по механизму действия делят на цитостатические и цитотоксические. Первые, цитостатические, тормозят размножение злокачественных клеток и вызывают их апоптоз, или программу самоуничтожения, клеточный распад. Вторые, цитотоксические, препараты вызывают гибель клеток вследствие их интоксикации, разрушения оболочки и ядра клетки, других структур, и в конечном итоге некроз опухоли.
Учитывая разные механизмы действия, в большинстве случаев онкологи подбирают комбинацию из двух-трех препаратов разных фармакологических групп.
К лекарственному лечению онкологических заболеваний относят:
- Химиотерапию.
- Гормональную терапию.
- Иммунотерапию.
- Таргетную терапию.
- Фотодинамическую терапию.
Лекарственное лечение обычно проводится курсами. Курс включает время введения препарата (от 1 до 5 дней для внутривенных препаратов, может быть дольше для таблетированных препаратов) и время перерыва для восстановления организма и снижения риска побочных эффектов лечения. Перед началом каждого нового курса обычно производится контроль анализов крови и консультация врача онколога для решения вопроса о необходимости корректировки доз препаратов и/или увеличения интервала до следующего введения препарата.
Для длительного лекарственного лечения есть понятие «линий» лечения. «Линия» лечения – последовательное назначение одинаковых курсов химио- (или других видов) терапии. «Линия» лечения проводится до достижения необходимого эффекта или до момента потери чувствительности со стороны болезни. Если опухоль продолжила расти на фоне одной схемы химиотерапии – производится смена лекарств. Продолжение лечения с использованием новой схемы химиотерапии называется «Второй (третьей, четвёртой и т.д.) линией» лечения.
Химиотерапия
Химиотерапия – наиболее распространённый вид лекарственной терапии. Химиотерапия бывает:
1. Лечебной – когда химиотерапия является основным методом лечения заболевания. Например, для многих пациентов с лейкозами, лимфомами, герминогенными опухолями яичка химиотерапия может быть основным методом лечения, который часто приводит к выздоровлению. Для большинства пациентов с распространёнными формами рака, с метастазами в различные органы, химиотерапия является основным методом лечения, дающим максимальную возможность длительно сдерживать болезнь.
2. Неоадъювантной – когда химиотерапия предшествует основному методу лечения. Чаще всего такая химиотерапия назначается перед некоторыми видами операций, с целью уменьшения опухоли и снижения активности её клеток.
3. Адъювантной – её ещё называют «профилактической». Она назначается после основного метода лечения, чаще всего после операции, с целью снижения риска возврата болезни.
К наиболее распространённым противоопухолевым препаратам относят следующие группы:
1. Алкилирующие антинеопластические препараты.
Механизм их действия основан на внедрение алкильной группы препарата к ДНК раковой клетки: происходит нарушение структуры ДНК и она не может дальше делиться, запускается апоптоз. В эту группу входят: производные бис-B-хлорэтиламина – исторически первые цитостатические противоопухолевые средства; производные нитрозомочевины и препараты платин, содержащие двухвалентную платину.
2. Алкилирующие триазины.
Неклассические алкилирующие агенты, пролекарства, которые для проявления своей противоопухолевой активности должны пройти ряд метаболических превращений в организме, в результате которых образуются метилирующие агенты. Последние, внедряясь в ДНК и РНК раковой клетки, не позволяют ей дальше делиться.
3. Антиметаболиты.
Конкурентно вмешиваются в процесс деления клетки, вызывая ее апоптоз.
4. Антрациклиновые антибиотики.
Механизм их действия основан на цитотоксическом действии. Они ингибируют синтез ДНК, нарушают проницаемость клеточных мембран и другие механизмы жизнедеятельности клеток.
5. Ингибиторы топоизомеразы I и топоизомеразы II, ингибиторы образования микротубул и ингибиторы веретена деления.
Цитостатические препараты, избирательно нарушающие структуру ДНК и деление раковых клеток на разных этапах.
Химиопрепараты в большинстве случаев вводятся внутривенно или перорально, тогда они оказывают системное воздействие на весь организм. Но могут быть использованы и местно, например, во время хирургической операции для обработки операционного поля, или регионарно, например, в желудочки головного мозга.
Гормональная терапия
Показана только для гормоночувствительных видов рака. Будет ли опухоль реагировать на лечение гормонами или нет, определят с помощью специальных анализов и лабораторных исследований клеточного материала, взятого из опухоли.
Опухоли, реагирующие на гормоны, часто обнаруживают в репродуктивной системе и железах внутренней секреции, например, это:
- рак молочной железы
- рак предстательной железы
- рак яичников
- рак эндометрия (рак тела матки).
Гормонотерапия может быть назначена до удаления опухоли с целью стабилизации ее роста или уменьшения размера, тогда она называется неоадъювантной. Или после – с целью предотвратить повторный рост или метастазирование, такую терапию называют адъювантной.
На поздних неоперабельных стадиях опухолей, чувствительных к данному лечению, гормональная терапия может использоваться в качестве основного лечения. Как паллиативное лечение некоторых видов рака она достаточно эффективна и может продлить жизнь пациента на 3-5 лет.
Иммунотерапия
Иммунитет играет важную роль в профилактике и борьбе с раком. В норме иммунные тельца распознают атипичную клетку и убивают ее, защищая организм от развития опухоли. Но когда иммунитет нарушается в силу разных причин, и раковых клеток становится много, тогда опухоль начинает расти.
Иммунотерапия при раке помогает организму справится с заболеванием за счет активизации защитных ресурсов и не допустить развития повторных опухолей и метастазов. В онкологии используют интерфероны, вакцины от рака, интерлейкины, колониестимулирующие факторы и другие иммунные препараты.
Лечение подбирает иммунолог на основе лабораторных данных о состоянии иммунной системы онкопациента совместно с лечащим врачом-онкологом и другими специалистами, участвующими в лечении конкретного пациента.
Основные механизмы иммунотерапии:
- подавление роста опухолевых клеток и их последующее уничтожение;
- профилактика рецидива опухоли и образования метастазов;
- уменьшения побочного влияния противоопухолевых средств, лучевой терапии;
- профилактика инфекционных осложнений при лечении опухолей.
Таргетная терапия
От английского target – цель, мишень. Относят к перспективным методам молекулярной медицины, будущему в лечении онкопатологий, как и разработку вакцин против рака.
Таргетные лекарства очень специфичны и разрабатываются под конкретный мутировавший ген раковой клетки данного вида опухоли. Поэтому до таргетного лечения обязательно проводят генетическое исследование материала, взятого на биопсию.
Например, разработаны эффективные таргетные препараты для лечения различных генетических форм рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы.
В силу своей специфики и целевого попадания на раковую клетку-мишень таргетные препараты более эффективны для лечения опухолей, чем например, классические противоопухолевые. И менее вредны для нормальных клеток, не обладающими характеристиками опухолевых. Многие таргетные методы относят к иммунотерапии, так как по сути они формируют нужный иммунный ответ.
Фотодинамическая терапия
Осуществляется препаратами, воздействуя световым потоком определённой длины волны на раковые клетки и разрушая их.
Побочные эффекты лекарственного лечения рака
Самое известное и пугающее онкопациентов осложнение после химиотерапии – выпадение волос. Происходит потому, что противоопухолевые препараты токсичны для молодых активно делящихся клеток, какими являются в том числе волосяные фолликулы и ногтевые пластины. На практике далеко не все виды химиотерапии вызывают выпадение волос. Это осложнение характерно для узкого спектра препаратов, многие пациенты с ним не сталкиваются. На время действия препарата может снижаться активность обновляющихся клеток организма, из-за чего перестают расти ногти и волосы, происходит выпадение волос, угнетается система кроветворения. После курса химиотерапии необходим восстановительный период, в течение которого организм приходит в норму.
Выраженные осложнения наблюдаются далеко не у всех пациентов, но риск их возрастает с увеличением продолжительности лечения.
Часто встречаются следующие побочные эффекты после проведения лекарственной терапии:
- выпадение волос, ломкость ногтей;
- тошнота, рвота;
- нарушение аппетита, изменение вкуса;
- анемия, кровотечение;
- нарушение иммунитета;
- диарея;
- бесплодие, нарушение сексуальной и репродуктивной сферы.
Большинство осложнений поддаётся корректировке, при правильном проведении лечения многие из них можно предотвратить или остановить при первом проявлении. Тяжёлые осложнения могут быть причиной увеличения интервалов между курсами химиотерапии.
Эффективность
Чем раньше обнаружен рак и точнее диагностирован тип опухолевых клеток, тем успешнее лечение рака и благоприятнее прогноз выздоровления. Поэтому следует постоянно следить за состоянием своего здоровья, проходить диагностические исследования согласно возрасту, не закрывать глаза на недомогание или периодический дискомфорт в теле. Также лучше не тратить время на попытки вылечиться самостоятельно или при помощи нетрадиционной медицины, не имеющей никаких убедительных данных об эффективности, игнорируя современные методы медицинского лечения. Так можно только запустить онкологический процесс, усугубить стадию заболевания и затруднить последующее лечение. Не теряйте драгоценное время, обследуйтесь в специализированных центрах на современном оборудовании у высококвалифицированных врачей.
Химиотерапия при раке: разновидности, особенности и лечение
Рак – самая коварная болезнь в мире с ежегодной миллионной смертностью.
Онкологические заболевания – это целая группа патологий, которые характеризуются образованием раковых клеток, уничтожающих иммунную систему и полностью разрушающих организм. Онкоболезни – одни из самых коварных в мире: ежегодно они уносят жизни миллионов людей разного пола и возраста. Именно поэтому вся мировая медицинская общественность работает над решением вопросов по разработке схем эффективного лечения рака. Ученые всего мира ведут непрерывную научную деятельность, в ходе которой создаются новые препараты и разрабатываются действенные методики лечения рака, одна из которых — химиотерапия при раке.

На данный момент одним из самых надежных методов лечения онкологических заболеваний является химиотерапия, которая подбирается индивидуально, в зависимости от характеристик конкретной опухоли и состояния здоровья пациента. Под понятием «химиотерапия при раке» в медицине понимается применение цитостатических препаратов, которые проникают в клетки злокачественной опухоли и разрушают их структуры.
С появлением цитостатических препаратов в онкологической медицине случился настоящий прорыв: курсы химиотерапии при раке помогают существенно замедлить скорость деления патогенных клеток и минимизировать рост опухолей. На начальных стадиях химиотерапия совместно с оперативным вмешательством может помочь полностью уничтожить очаг патологии, а если болезнь находится в запущенном состоянии, цитостатики способны замедлить развитие болезни и максимально продлить жизнь пациенту.
О том, насколько эффективна химиотерапия при раке следует судить по конкретному виду онкологии: существуют виды злокачественных опухолей, которые лечатся исключительно цитостатическими препаратами и их комбинацией. Уже много лет в онкологической медицине химиотерапия считается одним из самых действенных и результативных методов лечения рака.
Адъювантная и неоадъювантная химиотерапия при онкологии

Отвечая на вопрос: «Какая бывает химиотерапия при раке?» – следует рассмотреть ее основные виды, которые используются в мировой онкологической практике для предотвращения развития рака.
Онкологи-химиотерапевты выделяют следующие виды химиотерапевтического лечения:
- адъювантная химиотерапия;
- неоадъювантная химиотерапия;
- лечебная химиотерапия.
Каждый вид химиотерапии имеет свои цели и задачи, поэтому подбор лечения осуществляется, исходя из каждого конкретного клинического случая. Так, адъювантная химиотерапия при раке рекомендована пациентам в зависимости от морфологии опухоли и стадии заболевания, у которых было проведено оперативное вмешательство с целью удаления новообразований. Задача у такой терапии заключается в снижении риска прогрессирования болезни- появления новых метастазов, а также в предотвращении рецидивов заболевания.
Таким образом, очевидно, что дает химиотерапия при онкологии в этом случае: снижение риска повторного развития патологии, которого так боятся, как сами пациенты, так и онкологи, в арсенале которых не всегда имеются действенные методики лечения еще более опасного и скоротечного рецидивирующего рака.
Кроме этого, пациентам часто назначается неоадъювантная химиотерапия при раке, которая проводится перед хирургическим лечением опухоли. Цель проведения такой «химии» состоит в том, чтобы уменьшить размер неоперабельной опухоли или, например, выполнить, органосохранную операцию, а также выявить чувствительность онкоклеток к медикаментам, которые будут использоваться в послеоперационном периоде.
Кроме этого, существует также лечебная химиотерапия, которая назначается в качестве поддерживающей терапии больным на распространенных стадиях онкологического процесса. В данном случае влияние химиотерапии на организм сводится к тому, чтобы замедлить распространение опухоли и максимально повысить качество жизни пациентов, страдающих от онкологии.
В онкологической практике часто используются комбинированные схемы лечения, в процессе составления которых, химиотерапевты совмещают вышеуказанные виды химиотерапии при раке с целью повышения результативности лечения. Так, до операции часто назначается неоадъювантная химиотерапия, а после – адъювантная химиотерапия.
Ответ на вопрос о том, помогает ли химиотерапия при раке на 4 стадии, достаточно сложный, но большинство специалистов уверены, что отсутствие поддерживающего лечения может привести к появлению сильного болевого синдрома, возникновению осложнений, связанных с распространением опухоли на соседние ткани и органы и преждевременной смерти пациента.
Страхи перед проведением химиотерапии при раке

Многие пациенты онкологических диспансеров боятся лечения цитостатиками, ведь побочные после химиотерапии могут быть достаточно тяжелыми:
- повышение температуры тела;
- тошнота, рвота;
- выпадение и потеря волос;
- озноб и мышечные боли;
- слабость и головокружение;
- расстройства ЖКТ;
- потеря аппетита;
- подавленность, панические атаки;
- повышенная сонливость.
Интенсивная химиотерапия при раке – это серьезная нагрузка на сердечно-сосудистую и кровеносную системы. Однако бояться серьезных побочных эффектов не стоит: химиотерапевт назначает поддерживающее лечение, которое помогает максимально быстро восстановиться после курса лечения цитостатиками.
Перед тем, как проходить химиотерапию в стационаре, пациентам назначается перечень обследований с обязательной сдачей развернутого анализа крови и биохимии. Химиотерапия негативно влияет на формулу крови, поэтому в процессе проведения курсов лечения цитостатическими препаратами пациенты неоднократно проверяют состояние крови и сердечной мышцы (анализы, ЭКГ).
Опытный химиотерапевт параллельно с назначением химиолечения, рекомендует препараты для поддержания организма, которые сокращают количество и частоту проявления побочных эффектов.
Помните, химиотерапия – это один из ведущих методов исцеления от онкологических заболеваний во всем мире!
Продолжительность жизни большинства пациентов, которые отказываются от лечения, редко превышает 1 год.
Химиотерапевтическое лечение рака в стационаре: как проводится курс химиотерапии
Итак, эффективна ли химиотерапия при раке, и каким будет прогноз для пациентов, успешно прошедших курс цитостатического лечения? Любой онколог скажет, что химиотерапия уничтожает большую часть опухолевых клеток (а в некоторых видах онкологии способствует полному излечению!), улучшает общее самочувствие пациента и продлевает ему жизнь!
Перед тем, как положить пациента в стационар, лечащий врач подробно объясняет ему, как проходит курс химиотерапии при раке, а также дает рекомендации относительно питания, образа жизни и др. Здесь все будет зависеть от вида опухоли и выбранной схемы химиотерапии.
Пациенты, которые могут самостоятельно передвигаться, лежат в дневном стационаре, а «тяжелые» пациенты пребывают в отделении в течение всего курса химиотерапии. Врачи стационара предоставляют пациентам необходимую помощь при химиотерапии, а также оказывают моральную поддержку в борьбе с онкологическим заболеванием.
Задаваясь вопросом о том, как долго делают химиотерапию при онкологии, важно понимать, что каждый конкретный клинический случай индивидуален. При первичной онкологии курсы лечения цитостатиками будут короче и менее интенсивными, чем при рецидивирующем раке.

К примеру, химиотерапевт может назначить пациенту 4 курса химиотерапии, которые необходимо повторять с перерывом в 21 день. Однако, если у больного плохие показатели крови, врач не допустит его к следующей «химии». Поэтому сказать точно, как часто делают химиотерапию при онкологии и насколько дней растянется этот процесс, очень сложно. Как правило, если показатели анализов неудовлетворительны, то интервал между процедурами сдвигается на несколько дней до их восстановления.
Цитостатические препараты вводят внутривенно. Параллельно с ними врач назначает поддерживающие препараты с целью профилактики тошноты и рвоты, головокружения и прочих побочных эффектов. О том, сколько раз делают химиотерапию при раке, пациенту сообщает лечащий врач, однако, точную цифру тоже назвать сразу не получится – она определяется по результатам МРТ и КТ исследований. Лечение цикличное и при хорошей переносимости его могут продлить, но в большинстве случаев назначается 6 курсов химиотерапии.
Результаты химиотерапии: что могут современные цитостатики
Чтобы узнать, помогает ли химиотерапия при раке, достаточно сравнить результаты исследований пациента до и после лечения. В большинстве случаев после химиотерапии опухоль значительно уменьшается в размерах или даже совсем исчезает. Даже если онкологию не удается вылечить полностью, на фоне лечения цитостатиками она может просто «замереть» и долгие годы совершенно не беспокоить пациента.
Результаты лечения во многом будут зависеть от того, как соблюдаются интервалы между курсами, также от вовремя сделанного обследования, т. к. при прогрессировании заболевания необходимо менять схему лечения. Даже в случаях полной безнадежности, эффективность химиотерапии при онкологии достаточно высока: эти препараты повышают качество жизни и максимально ее продлевают.
При выявлении онкологии на первых стадиях, есть очень высокие шансы на полное выздоровление при помощи химиотерапии. При химотерапии крайне важно определить, какой курс химиотерапии, сколько курсов, какие интервалы лечения, какая продолжительность лечения, ведь незавершенное лечение может способствовать стремительному росту раковых клеток, которые невозможно контролировать.

Независимо от того, сколько дней химиотерапия при раке и каков был изначальный прогноз болезни, пациенты получают возможность полного или частичного исцеления, снижения болевого синдрома, а самое главное – надежду на выздоровление. Не пренебрегайте советами онкологов и строго следуйте разработанной схеме лечения, и тогда вы получите максимум шансов на исцеление, а также на долгую и полноценную жизнь!
Препараты для химиотерапии
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
За счет того, что опухолевые клетки быстро размножаются, они представляют собой идеальную мишень для химиотерапии. Но под удар, хотя и в меньшей степени, попадают и здоровые клетки организма. Сильнее всего страдают органы, в которых наиболее интенсивно происходят процессы клеточного деления: красный костный мозг, кожа (в том числе волосы и ногти), слизистые оболочки (ротовая полость, кишечник). Химиопрепараты обладают многочисленными побочными эффектами, справиться с ними помогает специальная поддерживающая терапия.
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Цитостатики и цитотоксические препараты
Традиционно противоопухолевые препараты делят на две группы:
-
останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Алкилирующие агенты
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Антиметаболиты
Эти препараты атакуют опухолевые клетки на стадии удвоения хромосом во время деления. Они нарушают синтез новых РНК и ДНК, занимая места нуклеотидов — «звеньев», из которых состоят цепочки нуклеиновых кислот. Антиметаболиты эффективны в качестве химиотерапии при раке кишечника, яичников, молочной железы, лейкемии.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Противоопухолевые антибиотики
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Ингибиторы топоизомеразы
Молекула ДНК состоит из двух цепочек, закрученных в спираль. Для того чтобы скопировать ее во время деления клетки, спираль нужно «распутать». За эту функцию отвечает особый фермент топоизомераза. Существуют средства для химиотерапии, которые блокируют его, тем самым нарушая процессы клеточного деления. Ингибиторы топоизомеразы эффективны при раке желудка и кишечника, яичников, легких, при лейкозах.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Ингибиторы митоза
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Винкаалкалоиды
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Таксаны
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Лекарства для химиотерапии, которые не относятся к каким-либо группам
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
- Как можно более раннее начало лечения. Пациент должен начать получать химиопрепараты сразу же, как только выявлены показания к их применению. К сожалению, в российских государственных клиниках дела с этим обстоят не лучшим образом. Зачастую не сразу удается попасть на прием к врачу и пройти необходимые обследования. Крупные онкологические центры постоянно сильно загружены, и пациентам приходится ждать своей очереди, чтобы начать лечение. Но рак не станет ждать, он прогрессирует, и со временем прогноз может ухудшиться. В «Евроонко» доступны все группы препаратов, и мы всегда начинаем терапию в кратчайшие сроки.
- Применение комбинаций препаратов. Обычно назначают 2–3 химиопрепарата с разными механизмами действия.
- Правильный подбор схемы химиотерапии. Разные типы рака обладают неодинаковой чувствительностью к тем или иным противоопухолевым препаратам. Врачи ориентируются на протоколы лечения. Эти документы составлены на основе результатов научных исследований с участием тысяч пациентов по всему миру, и в них расписаны сочетания препаратов, которые с наибольшей вероятностью будут эффективны при тех или иных злокачественных опухолях. На случай, если терапия первой линии не помогает, предусмотрены «запасные» варианты.
- В максимально короткие сроки нужно создать в тканях оптимальную концентрацию химиопрепарата и затем поддерживать её. Для этого важно правильно определиться с дозировками и частотой введений. Химиотерапию проводят циклами: больному вводят препараты, а затем дают некоторое время (обычно 1–3 недели) на «передышку». Курс может состоять из нескольких циклов.
- При неоперабельном раке лечение продолжают, пока препараты работают или не начинают вызывать тяжелые побочные эффекты.
- Пациент должен переносить химиотерапию комфортно. В «Евроонко» постоянно контролируют его состояние, проводят необходимые исследования и анализы, вводят противоопухолевые препараты под прикрытием поддерживающей терапии.

Дозировки
Подбор оптимальной дозы химиопрепаратов можно в какой-то степени сравнить с хождением по канату. Если дозировка будет слишком низкой, лечение станет недостаточно эффективным и ухудшится прогноз, а если слишком высокой, можно получить тяжелые осложнения. Ситуация осложняется тем, что «канат» у каждого пациента разной «толщины» — это зависит от размеров тела, индивидуальной способности организма метаболизировать лекарство.
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
Способы введения в организм
Чаще всего химиопрепараты вводят внутривенно или перорально (от латинского per os — «через рот»). Но существуют и другие пути введения:
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в «Евроонко» применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2–3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Врачи в «Евроонко» назначают поддерживающее лечение, которое помогает справиться с большинством побочных эффектов и комфортно пройти курс химиотерапии. Больной получает подробные рекомендации по поводу образа жизни, ему рассказывают, при возникновении каких симптомов нужно срочно обратиться к врачу.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Если рассматривать рак на молекулярно-генетическом уровне, то окажется, что двух одинаковых опухолей практически не существует. Каждый пациент индивидуален, каждому нужен свой подход при выборе комбинации химиопрепаратов. Такое лечение называется персонализированным. Оно наиболее эффективно, так как в нем реализован важнейший принцип медицины: «лечить не болезнь, а больного».
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Таргетная терапия и иммунотерапия: «усовершенствованные» химиопрепараты
Возможность изучать молекулярно-генетические характеристики рака привела к появлению относительно новой группы противоопухолевых средств — таргетных препаратов. Эти «снайперы» действуют на конкретные молекулы, которые необходимы злокачественным опухолям для роста, выживания, защиты от иммунитета. В отличие от классических химиопрепаратов, таргетные препараты не действуют на здоровые клетки, реже вызывают тяжелые побочные эффекты.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Выбор препаратов для восстановительного лечения после химиотерапии довольно большой. Важно не забывать и о таких «скучных» мерах, как правильный образ жизни, питание, полноценный сон и отдых, физическая активность. БАДы тоже могут быть полезны, но если вы решили принимать их, сначала нужно проконсультироваться с лечащим врачом.
На пути к безопасной химиотерапии

Новость
«Доспехи» из чертополоха: новая стратегия защиты печени от побочных эффектов лекарств.
рисунок автора статьи
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: На протяжении последних 50 лет химиотерапия, несмотря на серьёзные побочные эффекты, остаётся главным способом лечения рака. Значительный урон при этом наносится клеткам печени — гепатоцитам, в связи с чем понятие «гепатотоксичность» до недавнего времени было практически неотделимо от химиотерапии. Результаты новых исследований указывают на возможность сменить эту парадигму и сделать лечение рака гораздо более безопасным. Рассказываем о новом подходе, предложенном в 2020 году коллективом российских и американских учёных.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Лекарства из «чёрного ящика»
Приём некоторых лекарственных препаратов, включая противораковые, нередко сопровождается тяжелыми побочными эффектами. Зачастую врачи вынуждены приостанавливать назначенный пациенту курс химиотерапии из-за серьёзной нагрузки на печень, что может в конечном итоге привести к непоправимым последствиям , [1–4].
Из-за отсутствия лучшей альтернативы приходится использовать лекарства, балансирующие на тонкой грани между терапевтическим эффектом и колоссальным ущербом для организма. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов FDA (Food and Drug Administration) выделило такие препараты в отдельный список под названием black box warning (англ. — предупреждение: «чёрный ящик»). Эта маркировка означает предельно допустимый риск, которому подвергается пациент при приёме лекарства. Препараты из «чёрного ящика» могут привести к значительным или даже опасным для жизни побочным эффектам. Среди таких лекарств — дакарбазин, флутамид и гемтузумаб, на которых присутствует маркировка FDA с предупреждением о гепатотоксичности , [7].
Лекарственная гепатотоксичность — это появление структурно-функциональных поражений печени, вызванных приёмом фармацевтических препаратов.
Противораковые средства на основе дакарбазина широко используются в клинической практике для лечения злокачественной меланомы, саркомы мягких тканей, классической лимфомы Ходжкина и неходжкинской лимфомы [8]. Однако, несмотря на высокую терапевтическую эффективность, данные многочисленных исследований свидетельствуют о тяжёлых гепатотоксических побочных эффектах дакарбазина [4], [9–10]. При этом наибольший урон печени наносят активные формы кислорода — свободные радикалы, которые вырабатываются в ответ на приём противоракового лекарства [10].
Новая стратегия защиты печени
На базе Государственного университета Южной Дакоты российско-американский коллектив учёных разработал стратегию по защите печени от негативного влияния противораковых препаратов. Предложенный подход, не нарушая эффективности химиотерапии, позволяет значительно снизить показатели гепатотоксичности, при этом морфология печени остается близкой к нормальной. Успешность разработки была подтверждена в ходе экспериментов на животных. Результаты этого исследования опубликованы в журнале Frontiers in Bioengineering and Biotechnology [11]. Кроме того, новая стратегия по снижению побочных эффектов гепатотоксичных лекарств была защищена патентом.
В чём новизна?
Существующие в настоящее время методы защиты печени от гепатотоксичных лекарств предполагают продолжительный приём таблеток, содержащих молекулы-протекторы. Одним из наиболее часто используемых гепатопротекторов с доказанной клинической эффективностью является силимарин или его активный компонент – силибинин. Это вещество, полученное из семян расторопши (чертополоха), активирует антиоксидантные клеточные механизмы, напрямую нейтрализует свободные радикалы, препятствует провоспалительной активации макрофагов печени, вызванной приёмом лекарств.
Важно отметить, что фармакокинетика лекарств-гепатопротекторов, включая силибинин, далека от идеальной. Вводимые перорально, они очень быстро выводятся из организма, и лишь небольшая их часть достигает печени, что не позволяет в полной мере запустить защитные процессы. К тому же при таком подходе часть протекторных агентов может попадать в опухоль и оказывать нежелательное воздействие на ход противораковой терапии. Стандартный внутривенный способ введения этих молекул в свободном виде практически неосуществим из-за их низкой растворимости в воде.
Фармакокинетика — совокупность процессов, происходящих с лекарством после его попадания в организм: всасывание, распределение, метаболизм и выведение.
Чтобы преодолеть вышеуказанные ограничения, учёные разработали новую стратегию высокоэффективной доставки силибинина в печень путем его внутривенного введения в наноинкапсулированном виде. Препарат предназначен для использования перед началом химиотерапии в качестве превентивного средства. За счёт применения полимерных нанокапсул в качестве носителя гепатопротектор за короткое время и в достаточном количестве накапливается в тканях печени и запускает в них каскад реакций, благодаря которым активируются механизмы антиоксидантной защиты клеток. Таким образом, препарат позволяет эффективно «подготовить» печень к встрече с цитотоксическим противораковым лекарством.
Новый препарат стал результатом совместной работы химиков и специалистов по биомедицинской инженерии. Его активным компонентом является силибинин, а носителем служат нанокапсулы из полилактид-ко-гликолида — безопасного биоразлагаемого полимера (рис. 1). Разработанный метод инкапсуляции позволил получить однородные по размеру наночастицы с высоким содержанием силибинина (его массовая доля составила 15%). Одним из достоинств данного препарата является то, что активный компонент медленно выделяется из нанокапсул, что обеспечивает его повышенную концентрацию в тканях печени в течение продолжительного времени.
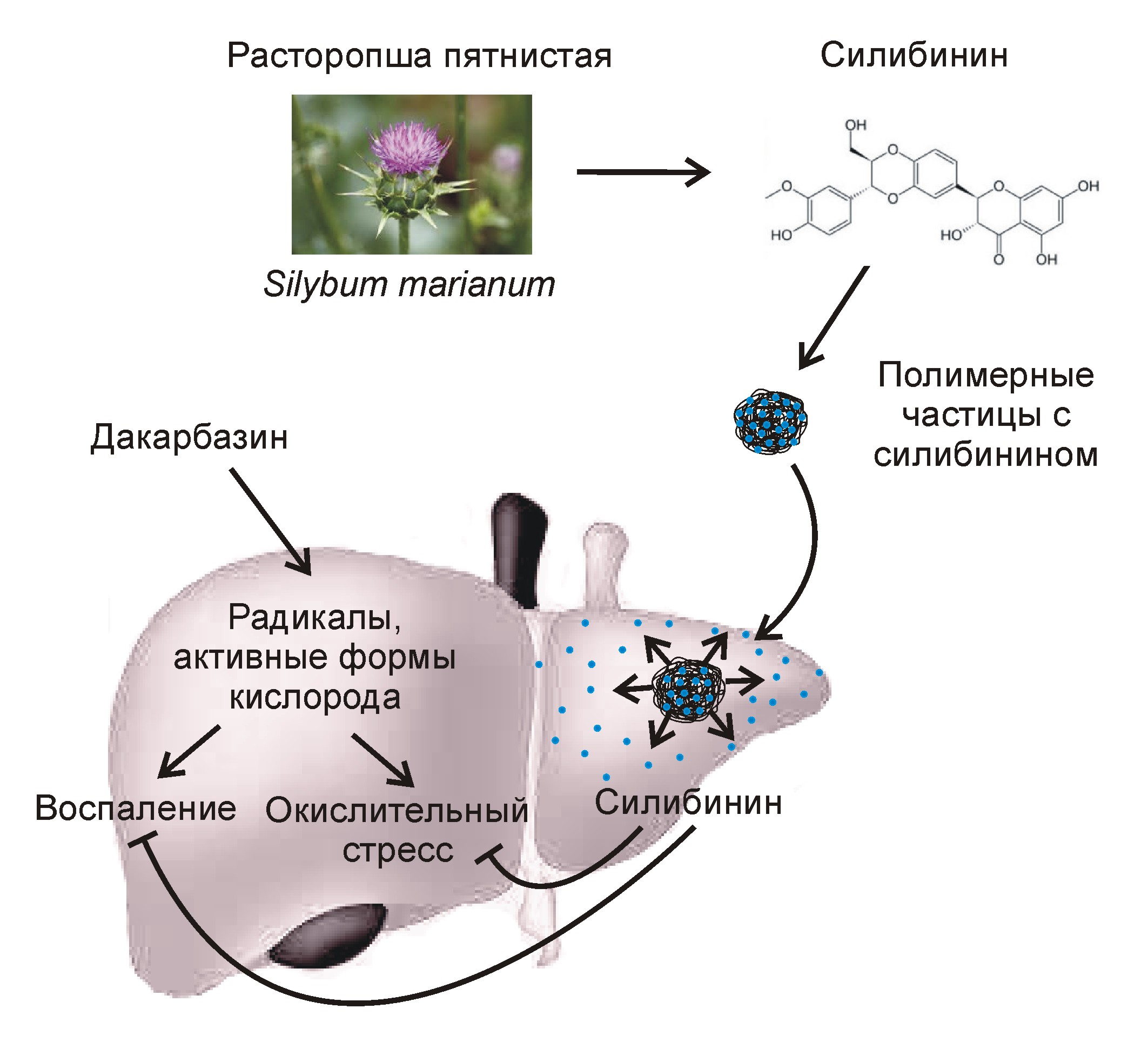
Рисунок 1. Препарат на основе силибинина и полимерных наночастиц для защиты печени от побочных эффектов противоракового лекарства (дакарбазина).
рисунок автора статьи
Превратить недостатки полимеров в достоинства
Любопытно, что классическим «недостатком» полимерных носителей для адресной доставки лекарств обычно считается их быстрое накопление в печени. Это серьёзно ограничивает возможности терапии с использованием полимерных носителей, т.к. в идеале они должны достигать очага поражения, минуя здоровые ткани и органы, в особенности — печень. Но в данном случае задача адресной доставки была совсем иной. Необходимо было обеспечить попадание молекулы-протектора именно в печень, и учёные превратили ключевой «недостаток» полимерных носителей в ощутимое преимущество.
Стоит отметить, что использование нанокапсул снижает риск локализации гепатопротектора в опухоли, что неизбежно при пероральном приеме таблеток. Таким образом, удаётся избежать возможного нежелательного воздействия этих молекул на эффективность противораковой терапии.
За счёт своей гидрофобной природы полимерные нанокапсулы после внутривенного введения быстро накапливаются в печени. Оказываясь в крови, эти частицы подвергаются опсонизации , после чего они становятся «узнаваемыми» для макрофагов печени и сразу же поглощаются ими. В данной работе наночастицы полилактид-ко-гликолида накапливались в печени уже в первый час после внутривенного введения. Используемый полимер после поглощения макрофагами подвергается гидролитической деградации до лактата и гликолевой кислоты, а высвобождающийся силибинин распространяется между соседними клетками печени.
Опсонизация — процесс адсорбции опсонинов (специальных белков) на поверхности инородных частиц, который стимулирует и облегчает их фагоцитоз.
Испытания на животных
В качестве противоопухолевого препарата, от которого нужно защищать печень, исследователи выбрали дакарбазин. Его часто используют для лечения злокачественных опухолей меланомы. К сожалению, несмотря на высокую терапевтическую эффективность, многочисленные исследования сообщают о гепатотоксических побочных эффектах лекарства, которые зачастую вынуждают прекращать терапию [4], [9]. В клинической практике наблюдались случаи острой печёночной недостаточности, веноокклюзионной болезни печени и даже смерти в течение нескольких дней после приёма дакарбазина.
В ходе доклинических испытаний животные с раковыми опухолями подвергались химиотерапии путём системного введения дакарбазина. Часть мышей проходила предварительную «подготовку», получая разработанный учёными препарат для защиты печени. Исследователи подобрали оптимальный временной интервал между введением протектора и дакарбазина, позволяющий получить наилучший защитный эффект. У животных, прошедших стандартную химиотерапию, были обнаружены признаки серьёзного повреждения печени — некроз сосудистого эндотелия, вакуолизация и некроз гепатоцитов. А морфология печени мышей, предварительно получавших протектор на основе нанокапсул и силибинина, была близка к нормальной (рис. 2).
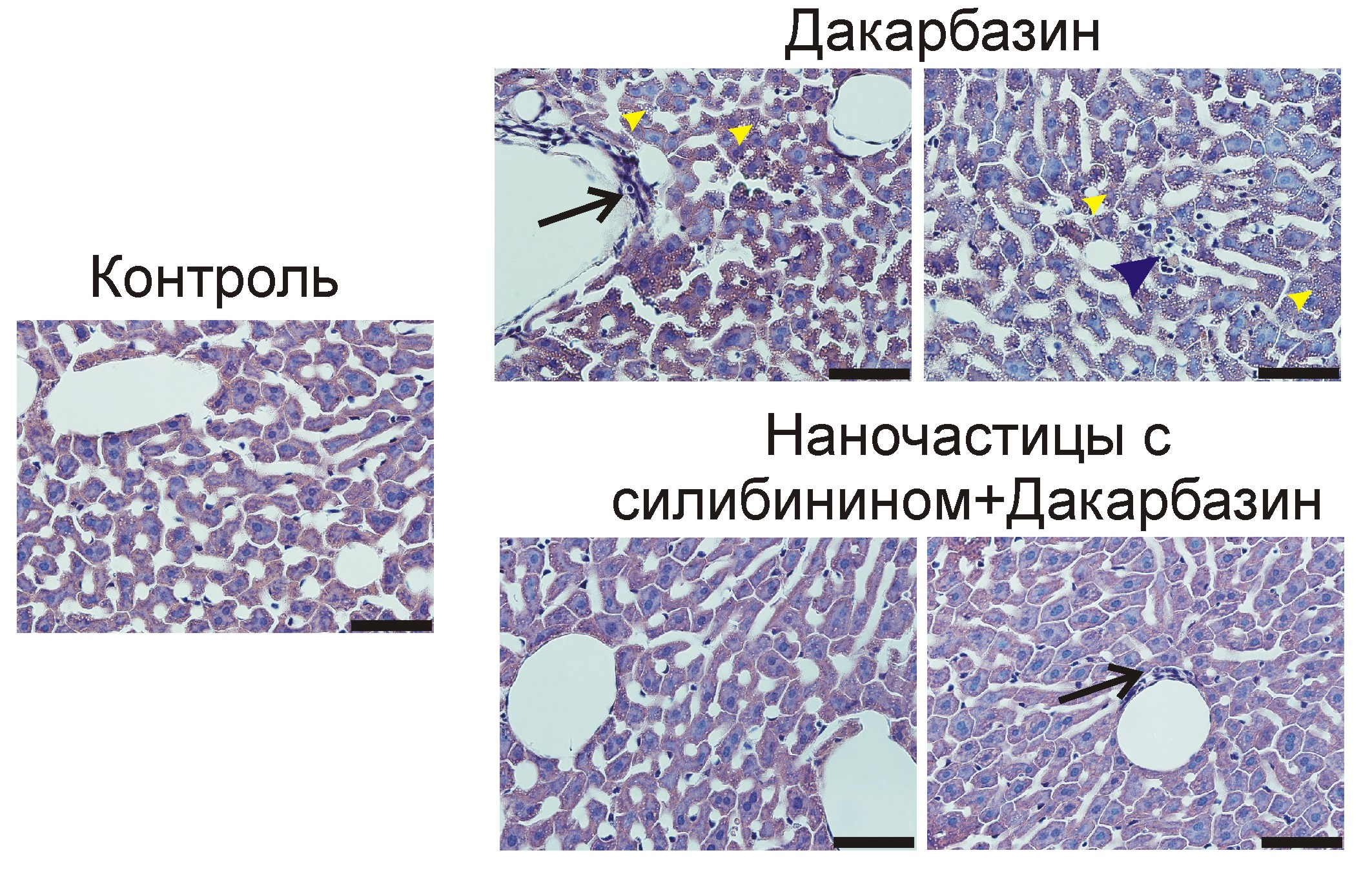
Рисунок 2. Морфология печени мышей, подвергавшихся воздействию дакарбазина и нового гепатопротектора. Контроль (нормальная морфология); дакарбазин (признаки повреждения печени); наночастицы с силибинином + дакарбазин (нормальная морфология, признаки повреждения отсутствуют). О некрозе гепатоцитов свидетельствует скопление лейкоцитов, поглощающих остатки погибших клеток (синяя стрелка). О некрозе сосудистого эндотелия свидетельствует скопление лейкоцитов в области эндотелия (чёрная стрелка). О вакуолизации свидетельствует наличие внутриклеточных пузырьков в гепатоцитах (жёлтые стрелки). Срезы окрашены гематоксилином и эозином.
Выбор оптимальных условий
Одним из механизмов действия силибинина является активация транскрипционного фактора Nrf2, который, в свою очередь, запускает в клетках экспрессию антиоксидантных ферментов, ферментов, восстанавливающих редокс-потенциал, и ферментов, способствующих деактивации свободных радикалов. Перед тем, как определиться с интервалом между введением протектора и дакарбазина, учёные поставили эксперимент, в котором определили, спустя какое время после однократного внутривенного введения протектора экспрессия этих ферментов в печени достигает максимальных значений. Именно это время соответствует наилучшей «подготовленности» клеток к встрече с цитотоксическим лекарством. Оно и было выбрано для дальнейших экспериментов в качестве интервала между введением протектора и дакарбазина (24 часа).
«Возможно, благодаря новой разработке удастся снять ограничения с широкого ряда лекарственных препаратов, использование которых лимитируется их гепатотоксичностью. Презентация наших работ в Бостоне на конференции CRS (Controlled Release Society) вызвала интерес со стороны фармацевтических компаний. Возможно, этот интерес перерастёт в проведение клинических испытаний», — отметил руководитель лаборатории, профессор Государственного университета Южной Дакоты Джошуа Рейнеке.
Все составные части разработанного препарата являются биосовместимыми и уже применяются в медицинской практике, что повышает шансы на ускоренный путь нового лекарства к клиническому использованию.
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент

Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
У ХТ существует три типа схем: высокоэметогенные (то есть «тошнотворные»), средние и низкие. Чтобы понять, к какому типу относится та или иная комбинация препаратов, химиотерапевт использует специальные схемы и таблицы. Поскольку вместе с опухолью под удар цитостатиков попадают и здоровые клетки, ХТ влечет за собой ярко выраженные побочные эффекты: снижение продукции клеток крови (миелосупрессия), воспаление слизистой оболочки рта (мукозит), выпадение волос, тошнота и рвота. Такой список способен напугать кого угодно, и Мария успокаивает:
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
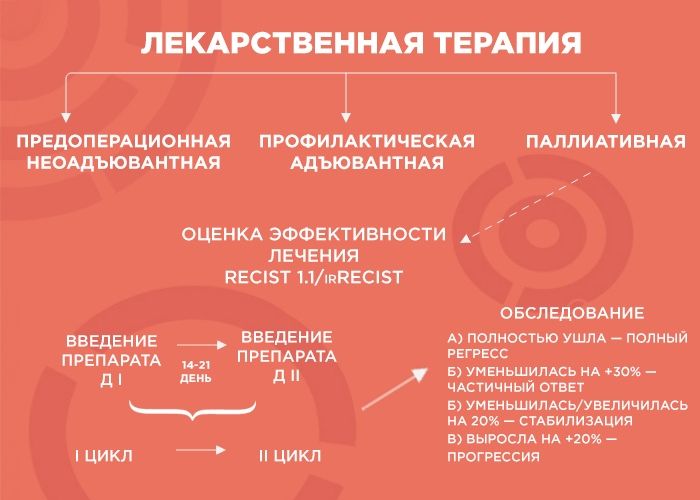
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.


