28. Дефект межжелудочковой перегородки: клиника, диагностика, лечение.
Дефект межжелудочковой перегородки – самый частый врожденный порок сердца. Дефект, т.е. отверстие в перегородке, разъединяющей правый и левый желудочки, бывает единственным нарушением нормального развития сердца, и тогда говорят об «изолированном дефекте», или частью другого, более сложного порока, например, тетрады Фалло.В межжелудочковой перегородке выделяют 3 отдела: верхняя часть – мембранозная, прилегает к центральному фиброзному телу, средняя часть – мышечная, и нижняя – трабекулярная. Соответственно этим отделам называют и дефекты межжелудочковой перегородки, однако большинство из них имеют перимембранозную локализацию (до 80%). На долю мышечных ДМЖП приходится 20%.
По размерам дефекты подразделяют на большие, средние и малые. Для правильной оценки величины дефекта его размер надо сравнивать с диаметром аорты. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части межжелудочковой перегородки, называются болезнью Толочинова–Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты межжелудочковой перегородки, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение.
Внутрисердечные гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3-5 сутки жизни. В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной легочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность (градиент) давлений между желудочками, вследствие чего появляется сброс крови слева-направо (из области высокого давления в область низкого давления). Дополнительный объём крови, поступающий в правый желудочек и легочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается легочная гипертензия.
Выделяют три стадии легочной гипертензии по В.И. Бураковскому.
1. Застой крови (гиперволемическая стадия легочной гипертензии) может приводить к отёку легких, частому присоединению инфекции, развитию пневмоний, манифестирующих в ранние сроки жизни, имеющих тяжелое течение и плохо поддающихся лечению. Если с гиперволемией не удается справиться консервативными методами, в таких случаях проводят паллиативную операцию – сужение легочной артерии по Мюллеру. Суть операции заключается в создании временного искусственного стеноза легочной артерии, который препятствует попаданию в МКК избыточного количества крови. Однако повышенная нагрузка, падающая при этом на правый желудочек, диктует в дальнейшем (спустя 3-6 месяцев) необходимость проведения радикальной операции.
2. При естественном течении порока со временем в сосудах малого круга кровообращения срабатывает рефлекс Китаева (спазмирование в ответ на перерастяжение), что приводит к развитию переходной стадии лёгочной гипертензии. В этот период ребенок перестает болеть, становится более активным, начинает прибавлять в весе. Стабильное состояние пациента в эту фазу является лучшим периодом для проведения радикальной операции. Давление в легочной артерии (и соответственно в правом желудочке) в эту фазу колеблется в пределах от 30 до 70 мм.рт.ст. Аускультативная картина характеризуется уменьшением интенсивности шума при появлении акцента II тона над лёгочной артерией.
3. В дальнейшем, если хирургическая коррекция ВПС не проводится, начинают формироваться процессы склерозирования сосудов легких (высокая легочная гипертензия – синдром Эйзенменгера). Этот патологический процесс не имеет обратного развития и приводит к значительному повышению давления в легочной артерии (иногда до 100-120 мм.рт.ст.).
Аускультативно можно выслушать резко выраженный акцент II тона над легочной артерией («металлический» оттенок). Систолический шум становится слабо-интенсивным, а в некоторых случаях может совсем отсутствовать. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла). В клинической картине заболевания отмечается множество патологических признаков: сердечный «горб», расширение границ относительной сердечной тупости, больше вправо. Над легкими выслушиваются участки ослабленного и жесткого дыхания, могут встречаться свистящие хрипы. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза, – сначала периферического, а в дальнейшем и диффузного. Это происходит вследствие перекрестного сброса крови в области дефекта межжелудочковой перегородки, который при превышении давления в правом желудочке становится право-левым, т.е. меняет свое направление. Наличие у пациента третьей стадии легочной гипертензии может стать основным мотивом отказа кардиохирургов от проведения операции.
Клиническая картина при ДМЖП заключается в симптомокомплексе сердечной недостаточности, развивающейся, как правило, на 1-3 месяцах жизни (в зависимости от размеров дефекта). Кроме признаков сердечной недостаточности ДМЖП может манифестировать ранними и тяжелыми пневмониями. При осмотре ребенка можно выявить тахикардию и одышку, расширение границ относительной сердечной тупости, смещение верхушечного толчка вниз и влево. В ряде случаев определяется симптом «кошачьего мурлыканья». Систолический шум, как правило, интенсивный, высушивается над всей областью сердца, хорошо проводится на правую сторону грудной клетки и на спину с максимальной интенсивностью в IV межреберье слева от грудины. При пальпации живота определяется гепатомегалия и спленомегалия. Изменения периферической пульсации не характерны. У детей с ДМЖП как правило быстро развивается гипертрофия.
Диагностика любого порока сердца складывается из рентгенологического исследования органов грудной полости, электрокардиографии и двухмерной допплерэхокардиографии.
При рентгенологическом исследовании органов грудной клетки описывают форму сердца и состояние легочного рисунка, определяют размер кардио-торакального индекса (КТИ). Все эти показатели имеют свои особенности при разных степенях лёгочной гипертензии. В первой, гиперволемической стадии, выявляется сглаженность талии и погруженность верхушки сердца в диафрагму, увеличение КТИ. Со стороны легочного рисунка отмечается его усиление, нечеткость, размытость. Крайней степенью гиперволемии в лёгких является отёк лёгких. В переходной стадии лёгочной гипертензии отмечается нормализация лёгочного рисунка, некоторая стабилизация размеров КТИ. Для склеротической стадии лёгочной гипертензии характерно значительное увеличение размеров сердца, причем в основном за счёт правых отделов, увеличение правого предсердия (формирование прямого атрио-вазального угла), выбухание дуги лёгочной артерии (индекс Мура более 50%), приподнятость верхушки сердца, которая образует с диафрагмой острый угол. Со стороны лёгочного рисунка часто описывается симптом «обрубленного дерева»: яркие, чёткие, увеличенные корни, на фоне которых лёгочный рисунок прослеживается только до определённого уровня. На периферии имеет место признаки эмфиземы. Грудная клетка имеет вздутую форму, ход ребер горизонтальный, диафрагма уплощена, стоит низко.
ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка – повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца – как предсердия, так и желудочка, – это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости – от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады. При допплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии. В первой стадии лёгочной гипертензии давление в ПЖ не превышает 30 мм.рт.ст., во второй стадии – от 30 до 70 мм.рт.ст., в третьей – более 70 мм.рт.ст.
Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков.В случаях высокой легочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента – капотен или каптоприл.
Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП – операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока – пластика дефекта межжелудочковой перегородки заплатой из листков перикарда в условиях искусственного кровообращения, кардиоплегии и гипотермии.
Дефект межжелудочковой перегородки
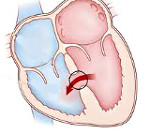
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью – такое состояние характеризуется как единственный желудочек сердца.

Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже – аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации – болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей – приточной, трабекулярной и отточной (инфундибулярной).
Межжелудочковая перегородка, наряду с другими стенками желудочков, принимает участие в сокращении и расслаблении сердца. У плода она полностью формируется к 4-5-ой неделе эмбрионального развития. Если этого по каким-либо причинам не происходит, в межжелудочковой перегородке остается дефект. Нарушения гемодинамики при дефекте межжелудочковой перегородки обусловлены сообщением левого желудочка с высоким давлением и правого желудочка с низким давлением (в норме в период систолы давление в левом желудочке в 4 – 5 раз выше, чем в правом).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки – 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) – расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки – 5% – расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца – «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки – частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Дефект межжелудочковой перегородки (Q21.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Дефект межжелудочковой перегородки (ДМЖП) – наиболее распространенный изолированный врожденный порок, обнаруживаемый при рождении. Довольно часто ДМЖП диагностируется и во взрослом возрасте.
При наличии показаний, проводят лечение порока в детстве. Нередко наблюдается спонтанное закрытие дефекта.
Классификация
Выделяют четыре возможные локализации дефекта межжелудочковой перегородки (ДМЖП):
1. Мембранозный, перимембранозный, коновентрикулярный – наиболее частая локализация дефекта, встречается в приблизительно 80 % всех ДМЖП. Дефект обнаруживается в мембранозной части межжелудочковой перегородки с возможным распространением на входной, септальный и выходной отдел перегородки; под аортальным клапаном и септальной створкой трикуспидального клапана; часто развиваются аневризмы Аневризма – расширение просвета кровеносного сосуда или полости сердца вследствие патологических изменений их стенок или аномалии развития
мембранозного отдела перегородки, в результате которых происходит частичное или полное закрытие дефекта.
2. Мышечный, трабекулярный – до 15-20 % случаев всех ДМЖП. Полностью окружен мышцей, может быть локализован в различных участках мышечного отдела межжелудочковой перегородки. Дефектов может быть несколько. Особенно часто наблюдается спонтанное закрытие.
3. Надгребневые, подартериальные, подлегочные, инфундибулярные дефекты выносящего тракта – встречаются приблизительно в 5 % случаев. Дефект локализуется под полулунными клапанами конусовидного или выходного отдела перегородки. Часто сочетается с прогрессирующей аортальной недостаточностью из-за пролапса Пролапс – смещение вниз какого-либо органа или ткани от его нормального положения; причиной такого смещения обычно бывает ослабление окружающих и поддерживающих его тканей.
створок аортального клапана (наиболее часто – правой).
4. Дефекты приносящего тракта (атриовентрикулярного канала) – входной отдел межжелудочковой перегородки непосредственно под местом прикрепления колец атриовентрикулярных клапанов; часто наблюдается при синдроме Дауна.
Чаще встречаются одиночные дефекты перегородки, но бывают и случаи множественных дефектов. ДМЖП также наблюдается при комбинированных пороках сердца, например, тетраде Фалло Тетрада Фалло – врожденный порок сердца: сочетание стеноза устья легочного ствола, дефекта межжелудочковой перегородки, смещения аорты вправо и вторично развивающейся гипертрофии правых отделов сердца
Подробно , корригированной транспозиции магистральных сосудов.
Этиология и патогенез
Формирование сердца с камерами и крупными сосудами происходит к концу первого триместра. Основные пороки развития сердца и крупных сосудов связаны с нарушением органогенеза на 3-8 неделе развития плода.
Приблизительно ко второму месяцу жизни ребенка снижаются толщина мышечной стенки, сосудистое сопротивление и давление в МКК (до 20-30 мм.рт.ст.). Давление в правом желудочке становится меньше, чем в левом, что приводит к сбросу крови слева направо, а значит и шуму.
Эпидемиология
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
– наличие детей с врожденными пороками сердца (ВПС);
– наличие ВПС у отца или ближайших родственников;
– наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Дефект межжелудочковой перегородки у плода
Изолированный ДМЖП у плода клинически делится на 2 формы в зависимости от его размеров, величины сброса крови:
1. Небольшие ДМЖП (болезнь Толочинова-Роже) – расположенны в основном в мышечной перегородке и не сопровождаются выраженными гемодинамическими нарушениями.
2. ДМЖП достаточно больших размеров – расположены в мембранозной части перегородки и приводят к выраженным нарушениям гемодинамики.
Клиника болезни Толочинова-Роже. Первое (иногда единственное) проявление порока – систолический шум в области сердца, появляющийся в основном с первых дней жизни ребенка. Жалобы отсутствуют, дети растут хорошо, границы сердца – в пределах возрастной нормы.
В III-IV межреберье слева от грудины у большинства больных выслушивается систолическое дрожание. Характерный симптом порока – грубый, очень громкий систолический шум. Шум занимает, как правило, всю систолу, нередко сливается со вторым тоном. Максимум звучания отмечается в III-IV межреберье от грудины. Шум хорошо проводится по всей области сердца, вправо за грудиной, выслушивается на спине в межлопаточном пространстве, хорошо проводится по костям, передается по воздуху и прослушивается, даже если поднять стетоскоп над сердцем (дистанционный шум).
У некоторых детей выслушивается очень нежный систолический шум, который лучше определяется в положении лежа. При физической нагрузке шум значительно уменьшается или даже полностью исчезает. Это объясняется тем, что благодаря мощному сокращению мышц сердца при нагрузке, отверстие в межжелудочковой перегородке у детей полностью закрывается и поток крови через него завершается. Признаков сердечной недостаточности при болезни Толочинова-Роже нет.
ДМЖП у детей старше года. Дефект переходит в стадию затухания клинических признаков за счет интенсивного роста и анатомического развития организма ребенка. В возрасте 1-2 лет наступает фаза относительной компенсации – одышка и тахикардия Тахикардия – повышенная частота сердечных сокращений (более 100 в 1 мин.)
отсутствуют. Дети становятся более активными, лучше прибавляют в весе и растут, реже болеют сопутствующими заболеваниями, многие из них по своему развитию догоняют сверстников.
Объективное обследование выявляет у 2/3 детей центрально расположенный сердечный горб, систолическое дрожание в III-IV межреберье слева от грудины. Границы сердца незначительно расширены в поперечнике и вверх. Верхушечный толчок – средней силы и усиленный.
При аускультации Аускультация – метод физикальной диагностики в медицине, заключающийся в выслушивании звуков, образующихся в процессе функционирования органов.
отмечается расщепление II тона во II межреберье слева у грудины, может наблюдается его акцентуация. Вдоль левого края грудины выслушивается грубый систолический шум с максимумом звучания в III межреберье слева и большой зоной распространения.
У части детей выслушиваются и диастолические шумы относительной недостаточности клапана легочной артерии:
– шум Грэхема – Стилла – появляется в результате усиления легочного кровообращения в легочной артерии и при нарастании легочной гипертензии; выслушивается в 2-3 межреберье слева от грудины и хорошо проводится вверх на основание сердца;
В зависимости от степени нарушения гемодинамики наблюдается очень большая вариабельность клинического течения ДМЖП у детей, которая требует различного терапевтического и хирургического подхода к таким детям.
Диагностика
1. Эхокардиография – является основным исследованием, позволяющим поставить диагноз. Проводится для оценки тяжести заболевания, определения локализации дефекта, количества и размера дефектов, степени перегрузки левого желудочка объемом. При исследовании необходимо проверить наличие недостаточности аортального клапана, возникающей как результат пролапса правой или некоронарной створки (в особенности при дефектах выносящего тракта и высоко локализованных мембранозных дефектах). Также очень важно исключить двухкамерный правый желудочек.
3. Катетеризация сердца проводится при высоком легочном артериальном давлении (по результатам ЭхоКГ) для определения легочного сосудистого сопротивления.
Дифференциальный диагноз
– открытый общий АВ-канал;
– общий артериальный ствол;
– отхождение магистральных сосудов от правого желудочка;
– изолированный стеноз легочной артерии;
– дефект аортолегочной перегородки;
– врожденная митральная недостаточность;
– стеноз аорты .
Осложнения
Пройти лечение в Корее, Израиле, Германии, США
Получить консультацию по медтуризму
Лечение
Тактика лечения дефектов межжелудочковой перегородки (ДМЖП) определяется гемодинамической значимостью дефекта и известным для него прогнозом. Поскольку существует высокая вероятность спонтанного закрытия дефектов (40% – на первом году жизни) или их уменьшения в размерах, у пациентов с сердечной недостаточностью целесообразно сначала прибегнуть к терапии диуретиками и дигоксином. Возможно применение ингибиторов синтеза АПФ, которые облегчают антеградный кровоток из левого желудочка и тем самым уменьшают сброс через ДМЖП.
Следует также обеспечить лечение сопутствующих заболеваний (анемия, инфекционные процессы), энергетически адекватное питание больных.
Для детей, поддающихся терапии, возможна отложенная операция. Хирургическое лечение, как правило, не показано детям с маленькими ДМЖП, достигшим шести месяцев без признаков сердечной недостаточности, легочной гипертензии или задержки развития. Коррекция порока обычно не показана при соотношении легочного и системного кровотоков (Qp/Qs) менее чем 1,5:1,0.
Показания к хирургическому вмешательству – сердечная недостаточность и задержка физического развития у детей, не поддающихся терапии. К операции прибегают, начиная с первого полугодия жизни. У детей старше одного года хирургическое вмешательство показано при Qp/Qs – более чем 2:1. При соотношении сопротивлений легочного и системного русла равном 0,5 или при наличии обратного сброса крови, возможность операции ставится под сомнение и необходим углубленный анализ причин данного состояния.
1. Паллиативные – заключаются в сужении легочной артерии для ограничения легочного кровотока. В настоящее время применяют только при наличии сопутствующих пороков и аномалий, затрудняющих первичную коррекцию ДМЖП.
2. Радикальные – заключаются в полном хирургическом закрытии дефекта. Операция выбора – закрытие дефекта в условиях искусственного кровообращения. Госпитальная летальность составляет 2-5%. Риск операции повышается у детей в возрасте до 3 месяцев, при наличии множественных ДМЖП или сопутствующих серьезных аномалий развития (поражения центральной нервной системы, легких, почек, генетические заболевания, недоношенность).
Прогноз
Во внутриутробном периоде дефект межжелудочковой перегородки не влияет на гемодинамику и развитие плода поскольку давление в желудочках равное и большого сброса крови не возникает.
Раннее ухудшение состояния ребенка после рождения маловероятно, поэтому родоразрешение в специализированном учреждении не является обязательным. Порок относится ко 2-й категории тяжести.
В постнатальном периоде:
– при небольших дефектах течение благоприятное, совместимое с длительной активной жизнью;
– при больших ДМЖП возможна гибель ребенка в первые месяцы жизни; критические состояния в этой группе развиваются у 18-21% больных, но в настоящее время летальность на первом году жизни не превышает 9%.
Спонтанное закрытие ДМЖП встречается в 45-78% случаев, однако точная вероятность данного события неизвестна. Например, большие дефекты в сочетании с синдромом Дауна или со значительной сердечной недостаточностью редко закрываются самостоятельно. Более часто спонтанно исчезают маленькие и мышечные ДМЖП . Более 40% отверстий закрываются на первом году жизни, но данный процесс может продолжаться и до 10 лет.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
– своевременное выявление порока;
– обеспечение надлежащего ухода за ребенком с ВПС;
– определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Дефекты межжелудочковой перегородки: симптомы, причины и лечение
 Один из самых распространённых врождённых пороков сердца – дефект межжелудочковой перегородки (ДМПЖ). Представляет собой не закрывшееся в процессе внутриутробного развития отверстие между правым и левым желудочками. Может самостоятельно затянуться либо требовать хирургического вмешательства, лекарственной терапии. Может быть единственным пороком развития либо сочетается с другими врождёнными пороками сердца (ВПС) и других органов.
Один из самых распространённых врождённых пороков сердца – дефект межжелудочковой перегородки (ДМПЖ). Представляет собой не закрывшееся в процессе внутриутробного развития отверстие между правым и левым желудочками. Может самостоятельно затянуться либо требовать хирургического вмешательства, лекарственной терапии. Может быть единственным пороком развития либо сочетается с другими врождёнными пороками сердца (ВПС) и других органов.
Виды дефектов развития
Межжелудочковая перегородка отделяет правый желудочек от левого и состоит из нижней мышечной и верхней соединительно-тканной частей. Дефект межжелудочковой перегородки у новорожденных может проявиться следующими вариантами:
- дефект мышечного отдела;
- дефект соединительно-тканного участка;
- рудиментарная перегородка;
- полное отсутствие межжелудочковой перегородки.
В зависимости от размера отверстия, давления в правом и левом желудочке выделяют дефекты:
Особенностью этого порока развития является постоянное изменение его значимости с ростом ребёнка. Отверстие может увеличиваться, уменьшаться, что ведёт к перестройке кровотока и накладывает отпечаток на клиническую картину заболевания.
Механизмы нарушения кровотока
- При малом размере дефекта
При дефектах в мышечной части межжелудочковой перегородки малого диаметра до 5 мм, значимых изменений не наблюдается.
 До 3-4 недели жизни порок сердца ДМПЖ не проявляется по причине изначально повышенного давления в системе лёгочных артерий у новорождённого, что не позволяет развиться перетоку крови из левых камер сердца в правый желудочек. На первом месяце жизни это давление снижается, величина перетока нарастает, и постепенно начинает проявляться сердечно-лёгочная недостаточность. Если нарушения гемодинамики значимы, то смертность у детей первого года жизни при таком пороке составляет 50%.
До 3-4 недели жизни порок сердца ДМПЖ не проявляется по причине изначально повышенного давления в системе лёгочных артерий у новорождённого, что не позволяет развиться перетоку крови из левых камер сердца в правый желудочек. На первом месяце жизни это давление снижается, величина перетока нарастает, и постепенно начинает проявляться сердечно-лёгочная недостаточность. Если нарушения гемодинамики значимы, то смертность у детей первого года жизни при таком пороке составляет 50%.
Если удаётся справиться с нарушениями гемодинамики, то состояние ребёнка компенсируется за счёт развития следующих компенсаторных механизмов:
- Рефлекторный спазм лёгочных сосудов предохраняет лёгкие от переполнения кровью.
- Повышенное давление в лёгочных сосудах ведёт к склерозу и необратимой дыхательной недостаточности.
- Сужение лёгочных сосудов ведёт к образованию вторичной тетрады Фалло, которая, кроме поражения межжелудочковой перегородки, проявляется стенозом лёгочной артерии, гипертрофией правого желудочка, декстрапозицией аорты.
- Уменьшение площади дефекта или полное его закрытие.
Каждый из вышеперечисленных механизмов носит поначалу компенсаторный характер, но при увеличении размеров окна постепенно развивается декомпенсация. Постепенно развивается сброс крови из левого желудочка в правый. Это не бывает в норме. Для того чтобы прокачивать кровь, гипертрофируется стенка правого желудочка. Интенсивность и выраженность гипертрофии зависят от размера окна и величины давления в лёгочных сосудах.
Причины возникновения
ДМЖП может появиться в результате:
- хромосомной аномалии;
- тератогенного воздействия на плод от 14 дня до 13 недели беременности;
- внутриутробной инфекции – краснуха, цитомегаловирус, вирус Коксаки, вирусы гриппа;
- употребление во время беременности лекарств – противоэпилептических, цитостатиков, противоопухолевых средств, психотропных, амфетаминов, прогестинов, противосудорожных, нестероидных противовоспалительных средств, этилового спирта, препаратов, изменяющих сознание;
- контакт беременной женщины с токсическими веществами – кислоты, спирты, тяжелые металлы;
- неблагоприятная экология (повышенный фон радиации, наличие мутагенных веществ в почве, воде, воздухе);
- болезни женщины во время беременности – повышение уровня сахара крови, преэклампсия, эклампсия, ожирение, токсикозы I триместра, болезни сердечно-сосудистой системы, мёртворождения в прошлом, ЭКО).
Клиника малых дефектов перегородки
Дефекты перегородки небольшого размера зачастую не вызывают субъективных жалоб. Ребёнок растёт и развивается нормально. Только на уровне 3 межреберья в левой половине грудной клетки определяется систолическое дрожание и специфический шум. Клинические проявления сердечной недостаточности и изменения на ЭКГ в этой ситуации отсутствуют.
Клиника средних дефектов перегородки
 При средних дефектах дети рождаются в срок. Может быть гипотрофия плода. На протяжении первого года жизни ребёнок часто болеет, отстаёт от сверстников в развитии. Имеются явления дыхательной, сердечной недостаточности – одышка при нагрузке, а с течением времени и в покое.
При средних дефектах дети рождаются в срок. Может быть гипотрофия плода. На протяжении первого года жизни ребёнок часто болеет, отстаёт от сверстников в развитии. Имеются явления дыхательной, сердечной недостаточности – одышка при нагрузке, а с течением времени и в покое.
Дрожание и систолические шумы в сердце имеются всегда. Ко 2 году жизни ребёнок начинает догонять в психическом и физическом развитии своих сверстников. Состояние стабилизируется, склонность к инфекционным и простудным заболеваниям снижается.
Клиника больших дефектов перегородки
В первые дни жизни у новорождённого при ДМПЖ больших размеров отмечаются признаки дыхательной и сердечной недостаточности в покое, при сосании и цианоз. Дети отстают в развитии, склонны к воспалительным заболеваниям верхних дыхательных путей, бронхитам, пневмониям. Сердечные шумы слышатся на расстоянии, появляется сердечный горб.
Независимо от степени тяжести процесса при ДМПЖ клиника у новорожденного имеет следующие фазы:
В фазе декомпенсации появляются признаки сердечной недостаточности:
- усиленная потливость;
- увеличение частоты дыхательных движений;
- повышенная утомляемость при сосании;
- уменьшение количества выделяемой мочи;
- отёки;
- нарушение ритма сердца;
- нарастание частоты сердечных сокращение;
- увеличение размеров печени, селезёнки.
Сочетание различных аномалий развития сердца
Такие врождённые пороки сердца, как дефект межжелудочковой перегородки часто сочетаются с другими аномалиями строения органов.
При незакрывшемся отверстии между желудочками целесообразно исключить:
- диафрагмальную грыжу;
- нарушение строения черепа, гидроцефалию;
- двухкамерный правый желудочек;
- аортальную недостаточность, недостаточность трикуспидального клапана;
- атрезию (отсутствие) пищевода;
- атрезию ануса.
Большое значение дефект межжелудочковой перегородки имеет в клинической медицине благодаря частой его сочетаемости с различными генетическими заболеваниями, например, карликовость, умственная отсталость, пороки половых органов, недоразвитие воздухоносных пазух черепа, разного рода психических отклонений.
Обследование
- рентгенография органов грудной клетки;
- электрокардиография;
- ЭХО-кардиография;
- УЗИ внутренних органов;
- нейросонография;
- КТ, МРТ;
- При низкой информативности неинвазивных методик используется катетеризация сердца;
- Консультация с кардиологом, кардиохирургом.
Важно! Золотой стандарт диагностики ВПС у новорождённых – эхоКГ. Цель диагностики: поставить предварительный диагноз и оказать своевременную помощь пациенту с врождённым пороком сердца.
При развитии сердечной недостаточности основная задача лечения: стабилизировать состояние для проведения детального обследования и транспортировки в кардиохирургический стационар.
С этой целью пациента госпитализируют в реанимационное отделение, проводится терапия, направленная на предотвращение развития угрожающих жизни осложнений сердечной и дыхательной недостаточности.
Лечебные мероприятия назначаются в зависимости от клинической картины состояния. Обязательно выполнение общих мероприятий, таких как:
- Создания условий жизнедеятельности организму в условиях температурного комфорта, т. к. это уменьшает потребление кислорода.
- Инфузионная терапия проводится по общим показаниям, нулевой или отрицательный водный баланс.
- Антибактериальная терапия по общим показаниям.
- Контроль диуреза. При задержки воды организмом, появлении отёков назначают мочегонные, например, фуросемид.
- Лечение направлено на предотвращение развития осложнений со стороны легких, почек, печени, центрально-нервной системы.
- Выявление пороков развития других органов.
- Генетическое обследование.
Медикаментозное лечение
При высокой лёгочной гипертензии применяются вазодилататоры – препараты простагландина Е 1.
- улучшает микроциркуляцию, кровоток на периферии;
- снижает свёртываемость крови.
- снижение АД, урежение частоты сердечных сокращений, нарушения ритма;
- остановка сердца;
- остановка дыхания;
- повышение температуры тела;
- судороги, нервное перевозбуждение, вялость, вялое состояние;
- диарея;
- отеки, гематурия, анурия;
- снижение уровня глюкозы и кальция крови;
- нарушения свёртывающей системы крови – ДВС-синдром, кровоизлияние в мозг, кровотечение, снижение количества эритроцитов, тромбоцитов;
- инфекционные осложнения.
У недоношенных детей риск осложнений значительно выше.
Хирургическое лечение
Оперативное лечение может быть выполнено открытым и внутрисосудистым методом.
Показания к открытому оперативному вмешательству:
- признаки перегрузки левого желудочка;
- наличие в прошлом перенесенного эндокардита.
Противопоказания: необратимая лёгочная гипертензия.
Во время операции ушивают дефект или ставят заплатку из биологического или синтетического материала на дефект межжелудочковой перегородки.
 В результате операции нормализуется давление в лёгочной артерии. Чем более сохранна функция левого желудочка, тем лучше результаты открытых операций.
В результате операции нормализуется давление в лёгочной артерии. Чем более сохранна функция левого желудочка, тем лучше результаты открытых операций.
Послеоперационная смертность: 1%.
У пациентов старших возрастных групп в ближайшем послеоперационном периоде может развиться фибрилляция предсердий, полная блокада сердца. Необходимость выполнения повторной операции может возникнуть через много лет при развитии недостаточности трикуспидального, аортального клапанов.
Показания к внутрисосудистому оперативному вмешательству:
- наличие ДМПЖ на большом расстоянии от трикуспидального, аортального клапана;
- гипертрофия левого желудочка;
- остаточные дефекты после предшествующих открытых операций;
- высокий риск открытого вмешательства из-за сопутствующих заболеваний других внутренних органов;
- дефекты в виде пчелиных сот.
Осложнения возникают в случае критических интраоперационных падений артериального давления и кровопотери, заключаются в нарушениях ритма.
Послеоперационное динамическое наблюдение
 Пациенты с остаточными дефектами межжелудочковой перегородки и минимальными проявлениями нарушений гемодинамики должны 1 раз в год проходить профилактическое контрольное обследование.
Пациенты с остаточными дефектами межжелудочковой перегородки и минимальными проявлениями нарушений гемодинамики должны 1 раз в год проходить профилактическое контрольное обследование.
При отсутствии каких-либо клинически значимых нарушений кровообращения, но с дефектом ДМПЖ необходимо проводить контрольное полное обследование 1 раз в 3 года.
Если дефект закрыт полностью и гемодинамически значимые нарушения отсутствуют, то наблюдения в условиях специализированного кардиохирургического центра не требуется.
При развитии послеоперационных осложнений кратность и длительность диспансерного наблюдения решается врачом индивидуально в зависимости от клинической ситуации.
Контрольное обследование включает:
Двигательная активность
Малые дефекты ДМПЖ, отсутствие сопутствующих пороков сердца, сохранная функция левого желудочка и сердечная проводимость не подразумевают каких-либо ограничений при физической активности.
При патологии лёгочных артерий ограничения движения производятся под контролем ощущений пациента.
Однако следует обратить внимание на необходимость исключения резких перепадов высоты, например, поездки в высокогорные районы.
Женщинам с дефектами больших размеров, лёгочной гипертензий, сердечной недостаточностью беременность противопоказана. Риск развития смертельных осложнений для матери и плода очень высокий из-за декомпенсации сердечно-лёгочных нарушений. При мелких дефектах и при отсутствии сопутствующей патологии беременность не противопоказана.
Рекомендации пациентам, перенесшим операции или самостоятельное закрытие дефекта, необходимо соблюдать режим сна, правильно питаться, с ограничением соли и достаточным поступлением воды в организм.
Дефект межжелудочковой перегородки: симптомы, диагностика, лечение

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Дефект межжелудочковой перегородки встречается в 15-20% случаев от всех врождённых пороков сердца. В зависимости от локализации дефекта выделяют перимембранозные (в мембранозной части перегородки) и мышечные дефекты, по величине – большие и малые.
Большие дефекты всегда расположены в мембранозной части перегородки, их размеры превышают 1 см (т.е. больше половины диаметра устья аорты). Гемодинамические изменения при этом определяет степень сброса крови слева направо. Тяжесть состояния, как и при других пороках со сбросом крови слева направо, напрямую зависит от выраженности лёгочной гипертензии. Выраженность лёгочной гипертензии, в свою очередь, определяют два фактора: гиперволемия малого круга кровообращения и передаточное давление (т.е. давление, передаваемое с аорты на лёгочную артерию по закону сообщающихся сосудов), так как большие дефекты чаще расположены подаортально. Подаортальное расположение дефекта способствует тому, что струя сброса оказывает гемодинамический удар на аортальные створки, повреждает эндокард, создавая условия для присоединения инфекционного процесса. Сброс крови в правый желудочек, а затем в систему лёгочной артерии происходит под высоким давлением (до 100 мм рт.ст.). Быстрое развитие лёгочной гипертензии впоследствии может привести к перекрёстному, а затем обратному сбросу через дефект.
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
Симптомы дефекта межжелудочковой перегородки
Порок манифестирует в первые недели и месяцы жизни. В трети случаев он обусловливает развитие тяжёлой сердечной недостаточности у новорождённых.
Дети с дефектом межжелудочковой перегородки рождаются чаще с нормальной массой тела, а затем плохо прибавляют в весе. Причина гипотрофии степени I-II – постоянное недоедание (алиментарный фактор) и нарушение гемодинамики (сброс крови слева направо приводит к гиповолемии малого круга кровообращения). Характерна потливость вследствие выделения кожей задержанной жидкости и гиперсимпатикотонии в ответ на сердечную недостаточность. Кожные покровы бледные с небольшим периферическим цианозом. Ранний симптом сердечной недостаточности – одышка по типу тахипноэ с участием вспомогательной мускулатуры. Нередко возникает навязчивый кашель, усиливающийся при перемене положения тела. Дефект межжелудочковой перегородки с большим артериовенозным сбросом сопровождается застойными хрипами, а зачастую и повторными пневмониями.
При физикальном исследовании сердечно-сосудистой системы визуально обнаруживают бистернальный килевидный сердечный «горб», образуемый за счёт увеличения правого желудочка («грудь Дэвиса»). Верхушечный толчок разлитой, усиленный; определяется патологический сердечный толчок. Можно обнаружить систолическое дрожание в третьем-четвёртом межреберье слева, свидетельствующее о сбросе крови в правый желудочек. Отсутствие дрожания – признак исходно малого сброса или его уменьшения в связи с высокой лёгочной гипертензией. Границы относительной сердечной тупости расширены в обе стороны, особенно влево. Правые границы относительной сердечной тупости увеличиваются перкуторно не более чем на 1-1,5 см, так как «жёсткие» структуры средостения не создают препятствия. Выслушивается грубый скребущего тембра систолический шум, связанный с I тоном, с максимальной точкой выслушивания в третьем-четвёртом межреберье (реже во втором-третьем) слева от грудины, II тон над лёгочной артерией акцентуирован, часто расщеплён.
В большинстве случаев с первых дней или месяцев жизни в клинической картине выражены признаки тотальной сердечной недостаточности: увеличение печени и селезёнки (у детей первых лет жизни селезёнка увеличивается содружественно с печенью).
При естественном течении порока состояние и самочувствие детей с возрастом улучшается в связи с уменьшением размеров дефекта по отношению к возросшему общему объёму сердца, прикрытием дефекта аортальной створкой.
При дефекте межжелудочковой перегородки в мышечной части (болезнь Толочинова-Роже) жалоб нет. клинические проявления порока отсутствуют, за исключением скребущего систолического шума средней интенсивности, выслушиваемого в четвёртом-пятом межреберье. Из этой точки шум не проводится, его интенсивность может уменьшаться в положении стоя. Лёгочная гипертензия не развивается, возможно спонтанное закрытие дефекта.
Осложнения дефекта межжелудочковой перегородки
Осложнение дефекта межжелудочковой перегородки – синдром Айзенменгера, характеризующийся значительным повышением давления в лёгочной артерии, когда оно становится равным или превышает давление в аорте. В этой гемодинамической ситуации шум основного порока (шум сброса) может ослабевать или полностью исчезать, нарастает акцент II тона на лёгочной артерии, часто приобретая «металлический» оттенок звучания. Сосуды малого круга кровообращения могут претерпевать морфологические изменения, склерозироваться – наступает склеротическая стадия лёгочной гипертензии. Направление сброса крови может измениться: кровь начинает сбрасываться справа налево, и порок бледного типа трансформируется в порок синего типа. Чаще всего подобная ситуация возникает при позднем выявлении порока, при его естественном течении, т.е. при отсутствии своевременной кардиохирургической помощи. При развитии синдрома Айзенменгера больные с врождённым пороком сердца становятся неоперабельными.
 [13], [14], [15], [16], [17], [18], [19], [20]
[13], [14], [15], [16], [17], [18], [19], [20]
Как распознается дефект межжелудочковой перегородки?
На ЭКГ обнаруживают отклонение электрической оси сердца вправо, признаки комбинированной перегрузки желудочков. Появление признаков гипертрофии правого желудочка в левых грудных отведениях часто коррелирует с высокой лёгочной гипертензией (более 50 мм рт.ст.).
Рентгенологическое обследование позволяет выявить гиперволемию малого круга кровообращения, увеличение размеров сердца за счёт обоих желудочков и предсердий. Обнаруживают выбухание дуги лёгочной артерии по левому контуру сердца.
Основной диагностический признак – непосредственная визуализация порока с помощью ЭхоКГ. Сканирование сердца в нескольких сечениях позволяет определить размер, локализацию и количество дефектов. С помощью допплеровского картирования устанавливают величину сброса.
Катетеризация сердца и ангиокардиография при простых дефектах межжелудочковой перегородки потеряли своё значение. Исследования показаны, если необходимо уточнить состояние малого круга кровообращения при высокой лёгочной гипертензии.
Дифференциальную диагностику необходимо проводить со всеми пороками, которые могут осложняться высокой лёгочной гипертензией.


